鈦合金植入材料是一種用于生物醫(yī)學領域的功能性結(jié)構(gòu)材料��,具有密度小����、比強度高����、生物相容性優(yōu)于不銹鋼和鉆基合金等優(yōu)點,主要被用于制造人工關(guān)節(jié)假體�����、牙種植體以及心血管支架等產(chǎn)品,具有廣闊的應用前景[1-3]��。但鈦合金植入材料的性能與自然骨相比仍有很大差距,生物相容性有待提高�。首先,鈦合金植入材料表面結(jié)構(gòu)與人體組織差異較大���,無法與周圍組織直接形成良好的骨結(jié)合,易導致手術(shù)失敗W此外����,鈦合金植入材料的彈性模量與人體骨骼彈性模量相比明顯偏高�,會產(chǎn)生應力屏蔽效應。以Ti-5Al-2.5Fe和Ti-6Al-7Nb為代表的α+β鈦合金的彈性模量為100~110 GPa,新開發(fā)的一些β型鈦合金彈性模量為40 -100 GPa,而人體密質(zhì)骨的彈性模量為4~30GPa,松質(zhì)骨的彈性模量僅為1~2 GPa[6 7] �����。
提高植入材料生物相容性的手段主要有等離子噴涂法和離子注入法等[8,9]���。前者是以等離子電弧作為熱源���,將陶瓷、純金屬�、合金等材料加熱到熔融或半熔融狀態(tài)后噴向工件表面,從而形成表面改性層的方法���;后者是在真空靶室中將高能離子束射到基材表面�����,從而在其表面獲得具有特定性能的改性涂層���。眾多研究證明�����,離子注入法可以顯著改善鈦合金植入材料的生物相容性、耐腐蝕性和抗菌性���。Qin等少[10]利用等離子體浸沒離子注入技術(shù)在鈦植入體表面制備了載有納米銀顆粒的TiO2納米管涂層,大幅提高了鈦植入體的抗菌性��。
通常�����,通過添加微量元素����、設計新型低模量β鈦合金或調(diào)整多孔鈦合金孔隙率的途徑來解決鈦植入體彈性模量與人體骨骼差異較大的問題[11,12]����。由于人體骨骼是從內(nèi)部疏松骨質(zhì)向表面致密骨質(zhì)逐漸變化的���,是典型的梯度多孔結(jié)構(gòu)。故開發(fā)與人體骨骼具有良好力學相容性和生物相容性的仿生結(jié)構(gòu)鈦合金植入材料成為近年來的研究熱點���。
為此����,從表面結(jié)構(gòu)及梯度結(jié)構(gòu)兩方面對仿生結(jié)構(gòu)鈦合金植入材料的制備及發(fā)展現(xiàn)狀進行介紹�,以期為鈦合金植入材料綜合性能的優(yōu)化提供參考。
1����、表面仿生結(jié)構(gòu)鈦合金及制備方法
仿生材料是通過模擬生物材料結(jié)構(gòu)和生命系統(tǒng)運行模式而設計制造的一種人工材料。仿生設計的實現(xiàn)�,需要模擬生物體的結(jié)構(gòu)及其功能[13]。人體骨骼表面具有不同大小的凹坑和溝槽�����,其中�,直徑1~100μm的微孑L可以促進細胞的生長,1~100μm的微孔可以促進細胞的增殖和蛋白質(zhì)的合成���。因此,根據(jù)仿生學理念���,將材料表面結(jié)構(gòu)設計為微孔結(jié)構(gòu),能夠增大植入材料的比表面積�����,提高表面能�����,更好地誘導植入體周圍骨組織的生長����,進一步提升材料的生物相容性����。
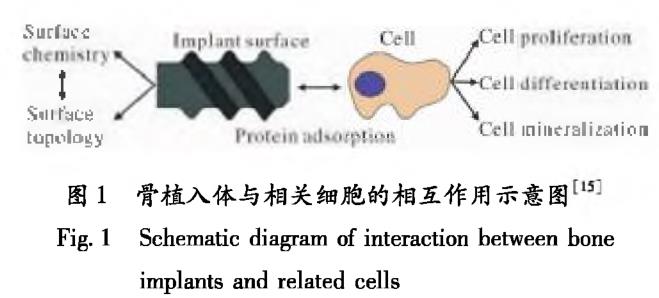
骨植入體對骨組織的修復效果主要取決于相關(guān)細胞的行為[14]���。圖1為骨植入體與相關(guān)細胞的相互作用示意圖[15]�����。當植入材料與人體血液接觸時����,血液中的某些蛋白質(zhì)會吸附在植入材料表面[16]。材料的表面結(jié)構(gòu)一方面會影響其表面蛋白的組成及數(shù)量,進而影響相關(guān)細胞的增殖���、分化以及礦化���;另一方面,表面結(jié)構(gòu)會對細胞與材料表面的接觸面積產(chǎn)生一定的影響���,進而影響細胞粘著斑的形成和細胞鋪展的形態(tài)[17��,18]�����。故植入材料需要提供合適的表面結(jié)構(gòu)���,這樣細胞才能與材料表面的一些特定蛋白質(zhì)發(fā)生作用,進而穩(wěn)定貼附于植入材料表面并對細胞外的信號進行響應�,從而將植入材料表面信息轉(zhuǎn)化為生物信號。目前��,適用于鈦合金材料的仿生表面改性方法主要包括電化學沉積技術(shù)����、激光熔覆技術(shù)及復合改性技術(shù)等����。
1.1電化學沉積技術(shù)
電化學沉積技術(shù)是在外電場作用下����,調(diào)節(jié)電極表面化學環(huán)境,通過氧化還原反應���,使溶液中的離子沉積到電極表面形成涂層[19]��。其突出優(yōu)點是可以在復雜形狀鈦植入體表面和多孔鈦基體表面制備涂層��。
Li等[20]利用電化學沉積法將含羥基磷灰石(HA)的碳化硅(SiC)納米顆粒沉積在陽極氧化的鈦納米管表面�����。研究表明,鈦陽極表面覆蓋SiC-HA納米顆粒后���,能夠有效促進成骨細胞的黏附�����。尹林玲[21]采用電化學沉積技術(shù)在鈦基體表面制備出一種載有殼聚糖/明膠/納米銀/氧化鋅的新型鈦納米管復合涂層�。該復合涂層具有良好的抗菌性能和生物相容性,能夠有效促進細胞的增殖和分化���。彭晴血]采用電化學沉積法在經(jīng)陽極氧化處理后的鈦植入體表面制備出Ti/TiO2/HA復合涂層�。研究表明���,HA表面的晶粒為納米尺寸���,呈垂直狀排列;復合涂層與鈦基體的結(jié)合強度較高���,為26.7 MPa,且表面細胞生長良好��,具有很好的生物相容性�����。毛世琪[23]采用電化學沉積法在鈦基底表面制備出氧化石墨烯/HA復合涂層�,該涂層微觀形貌均呈現(xiàn)棒狀多孔結(jié)構(gòu)����。由于氧化石墨烯具有良好的生物親和性,故該復合涂層的生物親和性相較于單一 HA涂層明顯提升。
1.2激光熔覆技術(shù)
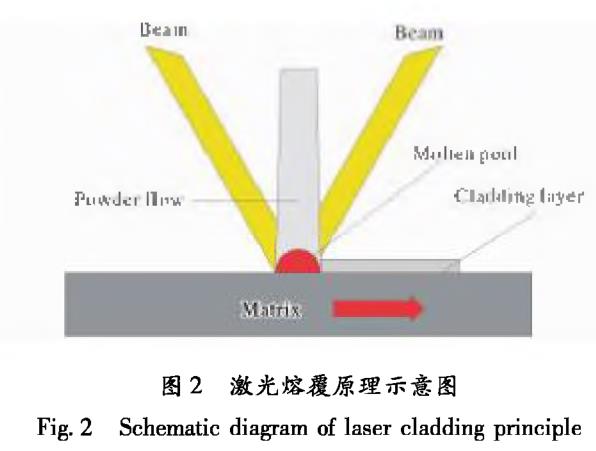
激光熔覆技術(shù)是利用高能激光束快速熔化金屬表面層和粉末材料形成熔池��,之后再冷卻形成具有特殊性能的涂層[24��,25]����。圖2為激光熔覆原理示意圖。該技術(shù)通過在基體表面形成熔覆層彌補基體材料性能的不足����,并且可以在指定的區(qū)域進行精確加工,具有較高的加工效率。
劉楠[26]首先在鈦植入體表面構(gòu)建了仿樹蛙皮膚形貌的六邊形納米結(jié)構(gòu)�,然后利用激光熔覆法制備出線陣列分布的鈦酸鈣(CaTiO3 )涂層。研究表明���,CaTiO3涂層具有良好的生物相容性�����,并且可以使骨組織與植入體之間牢固結(jié)合。Branemark等[27]利用激光對牙種植體進行處理�,在牙種植體表面形成具有微納米尺度的復合結(jié)構(gòu)。植入實驗結(jié)果表明���,經(jīng)激光處理后植入體的力學相容性和骨整合性能更好����。門博[28]通過激光熔覆技術(shù)在TI6Al4V合金表面構(gòu)建了微結(jié)構(gòu)陣列,并通過進一步酸蝕去除表面熔渣,從而形成多尺度的微納復合結(jié)構(gòu)����。研究表明,激光熔覆+酸蝕處理獲得的微納結(jié)構(gòu)具有良好的生物相容性���,有助于細胞的黏附和增殖���。
1.3復合改性技術(shù)
由于植入材料與人體骨骼的相互作用錯綜復雜,為制備出適宜人體內(nèi)部環(huán)境的植入材料,有時需要將不同技術(shù)結(jié)合起來���。付小明[29]采用微弧氧化法(MAO)以及水熱處理技術(shù)��,在Ti25Nb3Zr3Mo2Sn合金表面制備出粗糙多孔的納米HA仿生涂層�。研究表明�,該涂層結(jié)構(gòu)與牙本質(zhì)-牙骨質(zhì)復合體結(jié)構(gòu)相似,具有良好的生物相容性和較低的彈性模量�。Li等[30]首先利用MAO法在鈦基體表面涂覆一層多孔TiO2薄膜,然后將試樣放入堿性溶液中進行電化學還原�����,通過雙涂層工藝,制備了表面具有獨特微/納米形貌的鈦植入體��。體內(nèi)和體外實驗表明����,改性后細胞的初始黏附能力明顯增強,更有利于細胞的增殖�����。這種雙涂層工藝在提高鈦表面骨整合性能方面具有廣闊的應用前景�。黃千里[31]利用激光選區(qū)熔化成形技術(shù)(SLM)制備出Ti6A14V合金部件,并將MAO與水熱處理相結(jié)合�,在其表面構(gòu)建了含銅的仿生微納拓撲結(jié)構(gòu)涂層。研究表明�,該涂層具有抗菌和促進成骨的功能,在植入體表面改性領域有較大的應用潛力�����。許瑩等[32]采用陽極氧化法在鈦基體表面原位生長TiO2納米氧化層����,然后采用溶膠凝膠法在納米氧化層表面涂覆具有生物活性的微晶玻璃涂層(BGC),最終得到Ti/TiO2/BGC復合涂層。該復合涂層在模擬體液中浸泡后表面會生成大量的HA,表現(xiàn)出優(yōu)良的生物相容性���,且涂層親水性強����,與基體結(jié)合強度高���。王變[33]首先對鈦表面進行酸處理,獲得了微米臺階結(jié)構(gòu)���,然后利用水熱法在具有微米臺階的鈦表面原位生長TiO2納米棒,之后再采用等離子噴涂法噴涂鉗粉末�����,最終制備出TiO2/Ta復合涂層��。模擬體液生物活性實驗表明�,相較于未經(jīng)處理的鈦金屬,涂覆有復合涂層的鈦金屬表面沉積的HA更多�����,具有更優(yōu)異的生物相容性����。
2��、梯度結(jié)構(gòu)鈦合金及制備方法
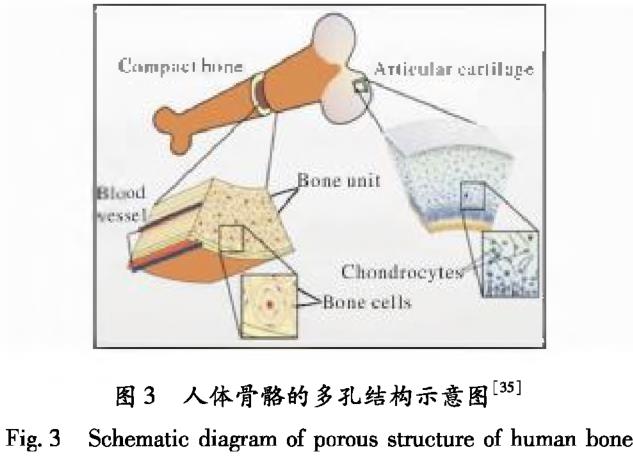
人體骨骼由內(nèi)部的松質(zhì)骨和外部的密質(zhì)骨構(gòu)成,最外層由微米級別的血管和層狀結(jié)構(gòu)的骨單位組成�。其中���,骨單位由HA納米顆粒以及納米膠原分子組成�,孔隙率從內(nèi)向外呈梯度變化�����。密質(zhì)骨的壓縮強度在100 ~230 MPa之間����,孔隙率在5% -10%之間;松質(zhì)骨的壓縮強度在0.3-1.5 MPa之間����,孔隙率在40% -90%之間⑶]。圖3為人體骨骼的多孔結(jié)構(gòu)示意圖回���。
許多生物材料在局部化學組成或結(jié)構(gòu)方面亦呈現(xiàn)出空間梯度特征�����,這種梯度結(jié)構(gòu)在提高生物材料力學性能的同時可賦予其一定的功能���。Miao等[36]將梯度多孔材料分為化學成分梯度多孔材料、孔徑梯度多孔材料和孔隙率梯度多孔材料��。梯度多孔材料的成分和組織呈連續(xù)變化���,沒有明顯的界面�����,不同位置的性能也不同��。根據(jù)不同的使用要求���,可以通過優(yōu)化梯度結(jié)構(gòu)材料的成分、組織以及結(jié)構(gòu)來滿足不同部位的性能需求���,并且梯度結(jié)構(gòu)能夠降低材料的彈性模量�����,提高強度�,滿足以往均勻結(jié)構(gòu)無法滿足的使用條件。常用的梯度材料制備方法有粉末冶金法���、等離子噴涂法以及3D打印技術(shù)���。
2.1粉末冶金法
粉末冶金是以金屬粉末(或金屬粉末與非金屬粉末的混合物)為原料,通過壓制成型����、燒結(jié)制造金屬制品的方法。該技術(shù)能夠較好地控制多孔材料的孔隙率和孔隙結(jié)構(gòu)�����,已廣泛用于多孔材料的制備�。與傳統(tǒng)的熔鑄法相比,可以減少或消除合金的成分偏析�,提高制品性能,且生產(chǎn)工藝簡單�,周期較短。
張帥[37]采用粉末冶金法�,在內(nèi)外兩層添加不同含量的NH4HCO3造孔劑,制備出新型醫(yī)用雙層梯度多孔Ti-14Mo-2.1Ta-0.9Nb-7Zr合金���。該合金的彈性模量約為20.91 GPa,抗壓強度約為1420 MPa,與人體密質(zhì)骨基本匹配�。Mihalcea等[38]利用粉末冶金技術(shù)制備了雙層結(jié)構(gòu)的植入體,其上層為致密的20CoCrMo,下層為多孔的Ti6A14Vo研究表明�,雙層Ti6A14V/20CoCrMo植入體內(nèi)部沒有裂紋,耐腐性能良好����,有較高的耐磨損性和較長的體內(nèi)壽命。王月勤等[39,40]創(chuàng)通過仿骨骼結(jié)構(gòu)進行設計�,以NH4HCO3為造孔劑��,制備出與人體骨骼結(jié)構(gòu)類似的梯度Ti-Mg復合材料�����。研究表明�����,隨著復合材料層數(shù)的增加,試樣的強度和彈性模量先升高后降低���,其中5層梯度結(jié)構(gòu)試樣的強度最高��,抗彎強度為16&3 MPa,抗彎模量為2.3 GPa����;梯度結(jié)構(gòu)Ti-Mg復合材料層間結(jié)合良好,未出現(xiàn)層間剝離現(xiàn)象�。
2.2等離子噴涂法
等離子噴涂法是利用直流電弧使氣體電離進而形成等離子流,然后通過高速噴射離子流使熔融粒子與基體碰撞在表面堆積形成涂層����。通過控制顆粒的熔化狀態(tài)和界面溫度,可以得到成分和結(jié)構(gòu)逐漸變化的梯度結(jié)構(gòu)材料��。
Singh等[41]采用大氣等離子噴涂工藝(APS)在TI6A14V合金表面連續(xù)噴涂3層功能梯度涂層�,成功制備出每層成分都不同的成分梯度材料。內(nèi)層涂覆TiO2粘結(jié)層����,以提高涂層結(jié)合強度;中間層涂覆結(jié)晶的HA并進行熱處理����,有助于提高界面之間的黏附性;外層噴涂HA層�����,較高的表面粗糙度和孔隙率可促進種植體與宿主骨骼的結(jié)合�。研究表明,所制備的梯度結(jié)構(gòu)各界面之間結(jié)合良好,梯度材料外層較高的孔隙率為骨組織提供了良好的生長條件��。
Kumari等[42]利用等離子噴涂技術(shù)在TI6Al4V合金表面制備了 HA-50% TiO2 (質(zhì)量分數(shù)��,下同)和HA-10%ZrO2雙層梯度結(jié)構(gòu)涂層�����。相較于只沉積HA-50% TiO2 或HA-10%Zr()2的單一結(jié)構(gòu)涂層�����,雙涂層試樣具有更好的生物相容性��。鮑雨梅等[42]利用同樣的方法在鈦基體表面分別制備了 HA/ZrO2和HA/HA-ZrOz/ZrO2梯度涂層�。研究表明����,該涂層各層間結(jié)合緊密,且結(jié)合強度隨著ZrO2層厚度的增加而增加����,同時ZrO2不會影響其生物活性。Khor等理利用等離子噴涂在鈦合金表面制備了 HA涂層和HA-Ti6A14V梯度涂層����。研究表明�,HA-Ti6A14V梯度涂層與基體的結(jié)合強度明顯高于單一 HA層��,并具有良好的力學性能和生物學性能���。Ning等[45]采用等離子噴涂工藝成功在Ti6Al4V合金表面制備出新型HA-ZrtVTi梯度涂層�。研究發(fā)現(xiàn)��,涂層的成分以及顯微組織呈梯度變化���,不同涂層之間無明顯的界面;熱處理后梯度涂層的結(jié)合強度達到53.6 MPa,遠高于單一HA涂層�����。
2.3 3D打印技術(shù)
3D打印技術(shù)又被稱為“快速成形技術(shù)”�,是將計算機設計出的三維數(shù)字模型分解成若干層平面切片����,然后由3D打印機把金屬粉末等材料按切片圖形逐層疊加,最終得到完整物體的增材制造技術(shù)�。該技術(shù)在生物多孔材料制備方面有著獨特優(yōu)勢。因采用的成形方法和使用的熱源不同����,3D打印技術(shù)又可分為選擇性激光燒結(jié)成形(SLS)�����、激光選區(qū)熔化成形(SLM)����、激光立體成形(LSF)�����、電子束選區(qū)熔化成形(EBSM)和電子束熔絲沉積成形(EBF)等�。這些技術(shù)中,EBSM的成形精度相對較高����,而且電子束功率大�,成形效率高,可以有效解決SLM不能成形大尺寸工件的劣勢����,具有更好的發(fā)展前景。表1對常見的鈦合金3D打印技術(shù)進行了對比跑�����。

Pei等⑷]首先利用計算機輔助設計軟件(CAD)設計了互連多孔結(jié)構(gòu)產(chǎn)品,然后通過有限元模擬的方法對產(chǎn)品的力學性能進行模擬研究并進一步優(yōu)化,最后以TI6A14V合金粉末(粒徑50~100 μm)為印刷材料���,采用SLM技術(shù)制造出用于修復股骨頭的鈦植入體�。該植入體的抗壓強度�����、彈性模量(約3.61 GPa)介于密質(zhì)骨與松質(zhì)骨之間����,且其多孔結(jié)構(gòu)十分有利于骨修復和再生。李磊[48]通過3D打印技術(shù)制備出仿生多孔鈦骨�。研究表明,該仿生多孔鈦骨表面為尺寸一致的網(wǎng)格狀結(jié)構(gòu)��,孔隙分布均勻���,相互貫通,有利于血液快速進入孔內(nèi)�,促進成骨細胞在多孔鈦骨表面附著�����,縮短骨結(jié)合時間,具有良好的生物學
性能���。Fousovd等網(wǎng)以氣體霧化法制備的Ti6Al4V合金粉末為原料���,采用SLM技術(shù)制備了 3種不同孔隙率的柱狀多孔試樣,其中1#��、2#試樣僅外層多孔,孔隙率分別為37.9%����、62.1% , 3鍛樣為全多孔鈦,孔隙率為79.2% ,如圖4所示。研究表明��,通過改變孔隙率可以調(diào)整多孔鈦的力學性能�,當孔隙率為62.1%時,多孔鈦的楊氏模量約為30.5 GPa,與人體骨骼相近�,可有效緩解應力屏蔽效應。

鈦合金3D打印技術(shù)作為一項前沿技術(shù)���,可以靈活控制孔隙參數(shù)���,并根據(jù)需要的形狀實現(xiàn)個性打印,具有廣闊的發(fā)展前景��。然而,該技術(shù)在國內(nèi)發(fā)展時間較短�����,仍存在精度較低�、設備及粉末原料成本較高、成形件易產(chǎn)生缺陷(球化����、裂紋、孔隙��、翹曲變形)等亟待解決的問題�。
3、結(jié)語
仿生結(jié)構(gòu)鈦合金植入材料的制備方法較多�����,但大多尚不完善��,還有很大的發(fā)展空間��。利用粉末冶金法制備梯度多孔結(jié)構(gòu)材料時����,非均質(zhì)粉末壓坯固化極容易引起材料的非均勻收縮����,仍需加強對制備工藝的研究����。3D打印技術(shù)雖容易控制孔隙結(jié)構(gòu),但對粉末材質(zhì)及設備的要求較高��,成形過程中缺陷的產(chǎn)生機理�����、新型鈦合金粉末的開發(fā)�����、成形材料強度的提高仍是今后研究的重點��。
此外�����,雖然仿生結(jié)構(gòu)鈦合金在近年來已得到較快的發(fā)展���,但在臨床應用方面仍受到一定的限制�����,因此��,在進行創(chuàng)新性研究的同時����,需加大其在醫(yī)用領域的成果轉(zhuǎn)化投入���,進一步推動仿生結(jié)構(gòu)鈦合金的發(fā)展和應用�����。
參考文獻 References
[1] 張文毓.生物醫(yī)用金屬材料研究現(xiàn)狀與應用進展[J].金屬世界���,2020(1): 21 -27.
[2] 任軍帥,張英明����,譚江,等.生物醫(yī)用鈦合金材料發(fā)展現(xiàn)狀及趨勢[〕]?材料導報�,2016, 30 ( Z28 ) : 384-388
[3] 武秋池,紀箴,賈成廠�����,等.鈦及鈦合金人體植入材料研究進展[J].粉末冶金技術(shù)�����,2019, 37 ( 3 ) : 225-232.
[4] 麻西群���,于振濤��,牛金龍���,等.新型生物醫(yī)用鈦合金的設計及應用進展[J].有色金屬材料與工程,2018, 39(6): 26-31.
[5] 于振濤�����,余森�����,程軍�,等.新型醫(yī)用鈦合金材料的研發(fā)和應用現(xiàn)狀[J].金屬學報,2017, 53 ( 10 ) : 1238-1264.
[6] 賈建剛,井勇智����,高昌琦,等.骨移植多孔鈦材料制備方法與發(fā)展概況[J].中國有色金屬學報�����,2019, 29(6): 1187-1197.
[7] 石志良��,黃琛�����,盧小龍��,等.Sphere梯度孔結(jié)構(gòu)力學性能有限元分析[J].中國生物醫(yī)學工程學報��,2019, 38(3): 339 -347.
[8] Zheng J P, Chen L J, Chen D Y, et al.Effects of pore size and porosity of surface-modified porous titanium implants on bone tissue ingrowth [ J].Transactions of Nonferrous Metals Society of China, 2019 , 29(12) : 2534 - 2545.
[9] 裴宇梁.醫(yī)用金屬材料表面功能涂層的構(gòu)建及其生物學性能的研究[D].太原:太原理工大學���,2019.
[10] Qin H, Cao H L, Zhao Y C, et al.In vitro and in vivo anti-biofilm effects of silver nanoparticles immobilized on titanium [J].Biomaterials, 2014, 35: 9114 -9125.
[11 ] Cai D G, Zhao X T, Yang L, et al.A novel biomedical titanium alloy with high antibacterial property and low elastic modulus [J].Journal of Materials Science & Technology,2021, 81: 13 -25.
[12] Li P Y, Ma X D, Tong T, et al.Microstructural and mechanical properties of jB-type Ti-Mo-Nb biomedical alloys with low elastic modulus [ J ].Journal of Alloys and Compounds, 2020, 815 : 152412.
[13] Zhao Y Q, Tang R K.Improvement of organisms by biomi- metic mineralization: a material incorporation strategy for biological modification [ J ].Acta Biomaterialia, 2021,120: 57-80?
[14] 王滕.鈦合金植入體微納雙級結(jié)構(gòu)表面設計制造及其生物相容性研究[D].濟南:山東大學,2017.
[15] Gittens R A, Olivares-Navarrete R, Schwartz Z, et al.Implant osseointegration and the role of microroughness and nanostructures : lessons for spine implants[ J].Acta Biomaterialia, 2014, 10(8) : 3363 -3371.
[16] Wilson C J, Clegg R E, Leavesley D I, et al.Mediation of biomaterial-cell interactions by adsorbed proteins: a review [J].Tissue Engineering, 2005, 11( 1/2) : 1 - 18.
[17] Olivares-Navarrete R, Rodil S E, Hyzy S L, et al.Role of integrin subunits in mesenchymal stem cell differentiation and osteoblast maturation on graphitic carbon-coated microstructured surfaces [ J ]? Biomaterials, 2015, 51: 69-79.
[18] Jeon H J, Simon C G, Kim G H.A mini-review: cell response to microscale, nanoscale, and hierarchical pattern- ing of surface structure [ J ].Journal of Biomedical Materials Research Part B: Applied Biomaterials, 2015, 102 ( 7 ):1580 - 1594.
[19] 葉偉.鈦表面電化學沉積納米疑基磷灰石涂層研究[D].杭州:浙江大學�����,2007.
[20] LiT, LiXL, Hu X S, et al.Enhanced osteoporotic effect of silicon carbide nanoparticles combine with nano- hydroxyapatite coated anodized titanium implant on healthy bone regeneration in femoral fracture[ J].Journal of Photo-chemistry & Photobiology B: Biology, 2019, 197: 111515.
[21] 尹林玲.新型鈦納米管復合涂層的抗菌和成骨活性研究[D].上海:上海交通大學,2019.
[22] 彭晴.純鈦表面Ti()2納米管及納米徑基磷灰石(nHA)制備與性能研究[D].湘潭:湘潭大學��,2015.
[23] 毛世祺.鈦基底上電化學沉積輕基磷灰石涂層[D].鄭州:鄭州大學���,2020.
[24] Dey D, Bal K S, Singh A K, et al.Hardness and wear behaviour of multiple component coating on Ti-6A1-4V sub- strate by laser applicationf J].Optik, 2020, 202: 163555.
[25] Li X, Zhang C H, Zhang X, et al.Manufacturing of Ti3 SiC2 lubricated Co-based alloy coatings using laser cladding technology [ J ].Optics and Laser Technology,2019, 114: 209-215.
[26] 劉楠.鈦基人工骨表面微納結(jié)構(gòu)設計制造及其生物相容性的研究[D].西安:陜西科技大學��,2019.
[27] Branemark R, Emanuelsson L, Palmquist A, et al.Bone response to laser-induced micro- and nano-size titanium sur- face features [J].Nanomedicine: Nanotechnology, Biology,and Medicine, 2011, 7(2) : 220 -227.
[28] 門博.鈦合金表面微納結(jié)構(gòu)設計制造及其生物活性研究[D].濟南:山東大學��,2015.
[29] 付小明.低彈性模量仿生種植體的基礎研究[D].福州:福建醫(yī)科大學����,2013.
[30] Li G L, Cao H L, Zhang W J, et al.Enhanced osseointe- gration of hierarchical micro/nanotopographic titanium fabri- cated by microarc oxidation and electrochemical treatment[J].Journal of Technology, 2016, 8(6) : 3840 -3852.
[31] 黃千里.醫(yī)用鈦合金的選擇性激光熔化成型與鈦表面電化學改性[D].北京:清華大學����,2017.
[32] 許瑩,何世宇��,王歡歡�,等.Ti/TiO2/BGC生物活性復合材料的制備及其性能研究[J].鋼鐵飢鈦,2018, 39(3): 33 -39.
[33] 王變.醫(yī)用鈦基金屬表面納米結(jié)構(gòu)的構(gòu)建及性能研究[D],唐山:華北理工大學����,2018.
[34] 許瑩,王歡歡��,王變.醫(yī)用多孔0鈦合金的制備方法研究進展[J].鈦工業(yè)進展,2018, 35(3): 1 -5.
[35] Stevens M M, George J H.Exploring and engineering the cell surface interface [ J ].Science, 2005, 310 ( 5751 ):1135 -1138.
[36 ] Miao X G, Sun D.Graded/gradient porous biomaterials[J].Materials, 2010, 3(1) : 26-47.
[37] 張帥.新型醫(yī)用梯度多孔Ti-Mo-Ta-Nb-Zr合金制備與組織性能研究[D].貴陽:貴州大學��,2016.
[38] Mihalcea E, Vergara-Hemandez H J, Jimenez 0, et al.Design and characterization of Ti6A14V/20CoCrMo-highly porous Ti6A14V biomedical bilayer processed by powder metallurgy [J].Transactions of Nonferrous Metals Society of China, 2021, 31(1) : 178 - 192?
[39] 王月勤 低模量多孔Ti?Mg系生物復合材料的制備與性能研究[D].南京:南京航空航天大學�����,2010.
[40] 張金龍.梯度多孔Ti-Mg基生物復合材料的制備與性能研究[D].南京:南京航空航天大學���,2011.
[41 ] Singh J, Chatha S S, Singh H.Synthesis and characteriza-tion of plasma sprayed functional gradient bioceramic coating for medical implant applications [J].Ceramics International,2021, 47(7): 9143 -9155.
[42] Kumari R, Majumdar J D? Studies on corrosion resistance and bio-activity of plasma spray deposited hydroxylapatite (HA) based TiO2 and ZrO2 dispersed composite coatings on titanium alloy ( Ti-6A1-4V) and the same after post spray heat treatment [ J ].Applied Surface Science, 2017, 420(5): 935 -943.
[43] 鮑雨梅���,陳賀�����,王成武.HA/ZK)2梯度涂層的制備及其抗沖擊性能研究[J]?浙江工業(yè)大學學報����,2019, 47(3): 237-242.
[44] Khor K A, Gu Y W, Quek C H, et al.Plasma spraying offunctionally graded hydroxyapatite/Ti-6Al-4V coatings [ J].Surface & Coatings Technology, 2003, 168 ( 2 ) : 195-201.
[45] Ning C Y, Wang Y J, Chen X F, et al.Mechanical performances and microstructural characteristics of plasma-sprayed bio-functionally gradient HA-ZrO2-Ti coatings [ J ].Surface & Coatings Technology, 2005 , 200 ( 7 ) : 2403_2408
[46] 唐超蘭,溫竟青����,張偉祥,等.鈦合金3D打印成形技術(shù)及缺陷[J].航空材料學報�,2019, 39(1): 38-47.
[47] Pei X, Zhang B Q, Fan Y J, et al.Bionic mechanical design of titanium bone tissue implants and 3D printing manufacture] J].Materials Letters, 2017, 208 (4) : 133-137.
[48] 李磊.3D打印仿生鈦骨表面復合涂層對成骨細胞相容性及抑菌性能的研究[D].青島:青島大學��,2017.
[49] Fousova M, Vojtech D, Kubasek J, et al.Promising characteristics of gradient porosity Ti-6A1-4V alloy prepared by SLM process [J].Journal of the Mechanical Behavior of Biomedical Materials, 2017, 69: 368 -376.
相關(guān)鏈接