生物醫(yī)用材料作為一類先進多功能材料可用于診斷����、治療��、修復(fù)或替代人體組織�、器官或增進其功能,
其獨特療效為藥物不可替代���。從醫(yī)用鈦合金材料的研發(fā)歷史和長期臨床應(yīng)用反饋表明��,其未來發(fā)展重點依然
是先通過研究其體外的生物相容性、力學(xué)相容性等基礎(chǔ)科學(xué)問題���,最終才能實現(xiàn)解決或改善其體內(nèi)的生物安
全性和服役長效性問題����。提高醫(yī)用鈦合金材料的生物及力學(xué)相容性是確保其在體內(nèi)長期穩(wěn)定服役并發(fā)揮持久
治療效果的關(guān)鍵����,也是設(shè)計和開發(fā)新型醫(yī)用鈦合金材料的研究基礎(chǔ)和應(yīng)用目標(biāo)。本文從醫(yī)用鈦合金材料合金
設(shè)計、物理冶金�、材料加工、組織與性能����、表面改性、先進制造及臨床應(yīng)用等諸方面進行了綜述���,并介紹了
作者研發(fā)團隊的最新進展�,展望了未來發(fā)展趨勢及待解決的問題�����。
1��、 合金化設(shè)計及新型合金材料開發(fā)
目前市場上外科植入物和矯形器械常用的金屬原材料主要包括不銹鋼����、Co-Cr基合金和鈦合金3大類,約
占整個生物材料產(chǎn)品市場份額的 40%左右[1]���。
鈦合金具有密度小�、比強度高�����、生物及力學(xué)相容性較好及易加工成型等特點,已發(fā)展成為一類量大面廣
的中高端外科植入物用的主要原材料����。從鈦合金牙種植體、人工關(guān)節(jié)等骨科硬組織修復(fù)替代到冠脈支架等血
管及軟組織微創(chuàng)介入等高端金屬器械產(chǎn)品的里程碑式的應(yīng)用至今�����,對其遠期療效暴露出的各種失效問題促使
人們不斷優(yōu)化和改良傳統(tǒng)的醫(yī)用鈦合金材料�,同時積極研究和開發(fā)新型優(yōu)良的醫(yī)用鈦合金材料。
1.1 醫(yī)用鈦合金材料的研發(fā)概述
鈦合金在生物醫(yī)學(xué)領(lǐng)域的研究可追溯到上世紀(jì)40 年代初期���,Bothe 等[2]和 Leventhal[3]通過動物實
驗最先證實了純 Ti 的良好生物安全性�;上世紀(jì) 50~60年代���,不銹鋼和Co-Cr合金得到廣泛應(yīng)用,而具有中
低強度的α型鈦合金包括純Ti和Ti3A12.5V鈦合金(TA18)開始在口腔種植體等承載較小的骨齒科部位獲得開
發(fā)和應(yīng)用嘗試[4,5]����。上世紀(jì)70年代后期,航空用具有中高強度的兩相鈦合金 Ti6A14V (α+β型�����,TC4、
TC4ELI)開始移植到醫(yī)學(xué)領(lǐng)域并迅速獲得推廣應(yīng)用[6~9]�。隨著鈦合金在臨床應(yīng)用的不斷深入,臨床醫(yī)生在實
施TC4鈦合金人工髖關(guān)節(jié)翻修手術(shù)時發(fā)現(xiàn)其生物學(xué)和生物力學(xué)性能不盡人意����。上世紀(jì) 90年代中期,瑞士和德
國先后開發(fā)出以 Nb 和 Fe 分別替代 V 的新型醫(yī)用兩相鈦合金 Ti6Al7Nb (TC20)和Ti5Al2.5Fe (TC15)
[10,11]�;但是隨后發(fā)現(xiàn)上述 2 種合金在生物安全性、生物力學(xué)相容性和加工成型性等方面仍有缺陷
(Ti5Al2.5Fe 合金已被國際醫(yī)學(xué)標(biāo)準(zhǔn)廢棄)���,且它們較高的彈性模量與 TC4 鈦合金相當(dāng)�����,這不利于與具有較
低彈性模量的骨組織的生物力學(xué)性能相匹配����。
上世紀(jì)90年代人們開始研發(fā)不含有毒元素����、高強度、低模量的第三代新型β型(包括全β型����、亞穩(wěn)β型
���、近β型或稱富α+β型)醫(yī)用鈦合金,已開發(fā)成功的新型β型鈦合金主要包括美國開發(fā)的Ti13Nb13Zr�����、日本開發(fā)的Ti15Mo5Zr3Al�����、德國開發(fā)的 Ti30Ta 等合金[12,13]��。我國從上世紀(jì)80年代開始醫(yī)用鈦合金材料的研究與開
發(fā)����,1999年西北有色金屬研究院在國內(nèi)首次研制出第一個具有我國自主知識產(chǎn)權(quán)的近α型醫(yī)用鈦合金
Ti3Al2Mo2Zr (TA24),2002 年研制出 2 種新型近 β型醫(yī)用鈦合金 Ti-5Zr-5Mo-15Nb (TLE)和Ti-5Zr-
3Sn-5Mo-15Nb(TLM)[14,15]���。另外����,中國科學(xué)院金屬研究所��、東北大學(xué)���、哈爾濱工業(yè)大學(xué)���、北京有色金屬研
究總院、寶雞有色金屬加工廠等單位也開展了新型β型鈦合金的基礎(chǔ)和應(yīng)用研究���。我國在醫(yī)用 β型鈦合金
研
發(fā)方面已走在國際前列�����,但尚無 β型鈦合金納入我國外科植入物材料國家標(biāo)準(zhǔn)���。
1.2 醫(yī)用鈦合金化設(shè)計及開發(fā)
1.2.1 醫(yī)用鈦合金化選材設(shè)計
開展新型醫(yī)用鈦合金化選材設(shè)計時,合金添加元素的細胞毒性是首要考慮因素��,同時要求所添加元素對
鈦合金綜合力學(xué)性能的不良影響最小�。金屬 Ti 具有同素異構(gòu)相轉(zhuǎn)變,在 882 ℃時從低溫的 α相(hcp 結(jié)
構(gòu))轉(zhuǎn)變?yōu)楦邷氐?β相(bcc 結(jié)構(gòu))�����。根據(jù)合金元素在 α相和 β相中的溶解度(或根據(jù)它們對相變溫度的影
響
)��,可將其合金元素大致分為α相穩(wěn)定元素、β相穩(wěn)定元素和中性元素�����。目前國內(nèi)外學(xué)者在進行醫(yī)用鈦合金
化
選材設(shè)計時����,主要選用對人體有益的鈦合金 β相穩(wěn)定元素Nb、Mo�����、Ta����、Hf和中性元素Zr、Sn以及α相穩(wěn)定
元
素 Al����、O、N 等合金元素���,而選材基本原則是根據(jù)合金元素在Ti及鈦合金中的作用及相圖決定的:一是利于
新合金形成單一均勻相(替代式或間隙式固溶體)�����,避免形成金屬間化合物等硬質(zhì)脆性相組織�;二是通過影響
a+b /β相變點�,有利于后續(xù)的加工、熱處理和顯微組織及力學(xué)性能調(diào)控��。
目前國內(nèi)外已報道的各類新型醫(yī)用鈦合金多達近百個��,合金設(shè)計包括二元系到六元系合金����,合金元素涉
及近20個[16]。一般來講��,α相穩(wěn)定元素Al�����、O�、N等對鈦合金的強化非常有效,但通常降低材料的塑韌性并
提高其彈性模量�����;而Zr、Nb���、Mo�����、Sn能夠使Ti基體強化而對塑韌性的不利影響較小����,同時對降低彈性模量有
利�����。Song等[17]通過對β型二元鈦合金中添加元素的電子結(jié)構(gòu)計算也同樣證實中性元素 Zr和β相穩(wěn)定元素
Mo
���、Ta�����、Nb有利于降低合金的彈性模量��,而α相穩(wěn)定元素Al可增加彈性模量[18]�,改變中性元素Sn在TiNbSn合
金中的含量對合金低屈服應(yīng)力和超彈性也有一定影響[19]�。針對新型β鈦合金成分多元化和力學(xué)相容性設(shè)計
要求���,除了需嚴格選擇和控制合金元素特別是 β相穩(wěn)定元素及配比(重量或原子比),特別需要關(guān)注合金多
元化后對性能的耦合影響��,因為已經(jīng)證實 Zr���、Sn、Mo�、Nb、Ta 等元素對多元鈦合金強度��、塑性和模量等理
化性能的影響��,與其在合金中配比存在非線性或定量依存關(guān)系����,不同元素對合金性能的影響各不相同,力學(xué)
性能隨著合金成分的變化顯得更加復(fù)雜�,這與二元合金的影響規(guī)律不盡相同[20]。O和N等氣體雜質(zhì)元素在提
高合金強度的同時也使得彈性模量增大����,因此通常按照微量元素來加入以調(diào)整其塑韌性及彈性允許應(yīng)變[21]
。另外����,Hf���、Ta、Nb元素雖然對合金低模量化和加工塑韌性調(diào)控有利���,但原材料價格昂貴�����、熔點較高���,不適
于低成本化鈦合金設(shè)計選材。
1.2.2 醫(yī)用鈦合金化設(shè)計方法概述
對于新型高強度低模量的介穩(wěn)定 β鈦合金的設(shè)計開發(fā)�����,當(dāng)前國際上大多采用 Mo 當(dāng)量公式�����、Kb穩(wěn)定化
系
數(shù)��、d-電子合金理論�、平均電子濃度 e/a�、第一性原理和分子軌道理論等方法進行合金成分設(shè)計和組織性能
的預(yù)測���。此外����,借助合金元素的熱力學(xué)和動力學(xué)參數(shù)��、不同相晶格參數(shù)等建立數(shù)據(jù)庫或?qū)嶒災(zāi)P?���,結(jié)合計算
分析軟件和方法也開發(fā)了諸如[團簇](連接原子)x結(jié)構(gòu)模型��、神經(jīng)網(wǎng)絡(luò)技術(shù)�����、模糊邏輯等方法����,這些合金設(shè)
計方法經(jīng)實驗驗證均取得了較理想的效果[22~25]。
Mo 當(dāng)量設(shè)計方法是目前獲得高強度鈦合金最簡便有效的途徑之一���。它主要通過事先計算出各種合金添
加元素的“Mo 當(dāng)量”數(shù)值來預(yù)測合金的相結(jié)構(gòu)與力學(xué)性能:當(dāng)Mo當(dāng)量在0~9之間時����,隨Mo當(dāng)量的增加,強度
相應(yīng)提高��。而 d-電子合金設(shè)計法是基于不同類型鈦合金在電子軌道相圖上的位置區(qū)間����,以及彈性模量和強
度在相圖上的排列規(guī)律來進行醫(yī)用鈦合金的設(shè)計:其一般設(shè)計準(zhǔn)則是首先確定合金具有低模量的電子軌道參數(shù),然后根據(jù)不同合金元素
的電子軌道參數(shù)及 d-電子理論�����,計算出合金的平均電子軌道參數(shù)�,使之符合設(shè)定的目標(biāo)。目前許多新型醫(yī)
用低模量β鈦合金采用該方法進行合金設(shè)計[24]��。此外���,根據(jù)平均價電子數(shù)與彈性模量的相關(guān)曲線規(guī)律����,
當(dāng)平均價電子數(shù)為 4.2~4.25 時合金模量較低�,日本學(xué)者采用此法率先開發(fā)出了基本成分為Ti(Nb、Ta���、V)+(Zr�����、Hf)+O的低模量β鈦合金-橡膠
金屬�����,該合金的平均價電子數(shù)約為4.24���,其彈性模量與人體骨接近�,但強度等性能較低而未在外科植入物領(lǐng)
域獲得實際應(yīng)用[26]�����。Hu 等[23]發(fā)明的新型 Ti2448(Ti24Nb4Zr7.6Sn) 鈦合金 �����,其平均價電子數(shù)
只有4.15����,理論上并不在低模量區(qū)間��,但實際模量最低可達 40 GPa。因此��,該法對新型醫(yī)用鈦合金的設(shè)計
不具普適性��。模糊邏輯和神經(jīng)網(wǎng)絡(luò)技術(shù)的合金設(shè)計法首先都需要大量的合金成分及相應(yīng)的性能數(shù)據(jù)��,然后使
用模糊邏輯推理軟件或神經(jīng)網(wǎng)絡(luò)軟件建立合金成分與性能的數(shù)學(xué)模型��,再利用其它數(shù)據(jù)進行不斷修正以達到
對合金成分優(yōu)化和性能預(yù)測的目的��,但該類設(shè)計方法目前尚不完善[22]����。
1.2.3 新型醫(yī)用鈦合金的開發(fā)
目前國際上已設(shè)計成功的低模量醫(yī)用β鈦合金多達20余種 ,已被納入國際標(biāo)準(zhǔn)的新型醫(yī)用β鈦合金有
Ti13Nb13Zr�����、Ti12Mo6Zr2Fe (TMZF)���、Ti15Mo��、 Ti15Mo5Zr3Al和Ti45Nb等��,其中前3種是為了降低應(yīng)力屏蔽
效應(yīng)和提高其生物力學(xué)相容性的要求由美國
設(shè)計開發(fā)的[27,28]����。Ti15Mo5Zr3Al 是日本神戶制鋼在 Ti15Mo 的基礎(chǔ)上按照提高耐蝕性和強度的要求進行
設(shè)計的。Ti45Nb 合金起初也是由美國按航空航天用緊固件等零部件的要求進行設(shè)計�,隨后由于其高強度、
低模量和耐蝕性好等綜合性能而被引入生物醫(yī)學(xué)工程領(lǐng)域[29]�。隨著低模量 β鈦合金的不斷應(yīng)用,日本開
展
了大量的研究開發(fā)工作����,其中日本大同特殊鋼公司基于 DV-Xa 理論采用 d-電子合金設(shè)計方法開發(fā)出了彈性
模量最低約 55 GPa 的 Ti29Nb13Ta4.6Zr (TNTZ)亞穩(wěn)β鈦合金。為了降低 TNTZ 合金成本和彈性模量�,提
高其強度及疲勞性能,Niinomi 等[30~35]又分別通過添加不同含量的 O 元素和 Cr 元素以及采用大塑性變
形����、累積連續(xù)冷軋、變形誘發(fā)相變��、熱機械處理等方法來優(yōu)化合金的強度����、彈性模量�����、塑性和超彈性等綜合
力學(xué)性能,揭示了 TNTZ 合金的模量隨高壓扭轉(zhuǎn)次數(shù)或織構(gòu)的增加而降低以及單晶 TNTZ對晶體取向的依賴
性��;通過提高 O 含量來抑制無熱 w 相的生成��,增加 Cr 元素和合金冷變形使其彈性模量從 64 GPa 提高至
77 GPa�����,并因此提出了脊柱固定器用“自調(diào)節(jié)模量”類鈦合金的設(shè)計方法���。
目前��,能夠達到模量自調(diào)節(jié)的新型鈦合金除了Ti-Cr 系合金����,隨后又開發(fā)了 Ti17Mo����、Ti30Zr5Cr、
Ti30Zr7Mo����、Ti30Zr3Mo3Cr 等合金。日本科研人員設(shè)計的低模量鈦合金大多是在 TNTZ 基礎(chǔ)上陸續(xù)發(fā)展的,
主要通過改變合金元素及其成分并立足低成本化理念來進行設(shè)計和研究[36,37]���,其應(yīng)用方向不僅僅限于生
物醫(yī)學(xué)工程領(lǐng)域����。
西北有色金屬研究院自上世紀(jì) 80 年代開始致力于各類醫(yī)用鈦合金材料的設(shè)計和開發(fā)����,尤其是在鈦合金
材料的產(chǎn)業(yè)化應(yīng)用研究方面走在國際前列。自 1999 年 以 來 已 先 后 開 發(fā) 出 Ti2.5Al2.5Mo2.5Zr
(TAMZ)�、Ti3Zr2Sn3Mo25Nb (TLM)、Ti15Nb5Zr3Mo(TLE)��、Ti10Mo6Zr4Sn3Nb (TB12)等多種新型醫(yī)用鈦合金并
均獲國家發(fā)明專利����。2002 年于振濤教授研發(fā)團隊研制出了 2 種新型介穩(wěn)定 β型鈦合金TLM、TLE�����,其設(shè)計
原則是:(1) 選擇對人體無毒性����、可在α-Ti和β-Ti中充分固溶以及較低成本的合金元素,并選定Ti-Nb二
元
系作為合金設(shè)計的基礎(chǔ)體系����;(2) 采用 d 電子理論、Mo 當(dāng)量經(jīng)驗公式及 Kb穩(wěn)定系數(shù)相結(jié)合的方法�,根據(jù)
鈦合金二元相圖及 d 電子軌道相圖計算,選擇能夠產(chǎn)生亞穩(wěn)態(tài)相變及馬氏體轉(zhuǎn)變而使合金室溫下處于介穩(wěn)
定相狀態(tài)的設(shè)計參數(shù)�;(3) 依據(jù)第一性原理計算了合金元素Sn�、Zr���、Mo及其含量對鈦合金強度�����、模量及馬氏
體轉(zhuǎn)變溫度等因素的影響�,并預(yù)先充分考慮了鈦合金冷��、熱加工成型性特點��,最后通過一系列工業(yè)實驗驗證
而成功獲得了具有綜合力學(xué)性能寬泛且可調(diào)控的新型高強度低模量醫(yī)用鈦合金����,該研發(fā)團隊開發(fā)的系列新型
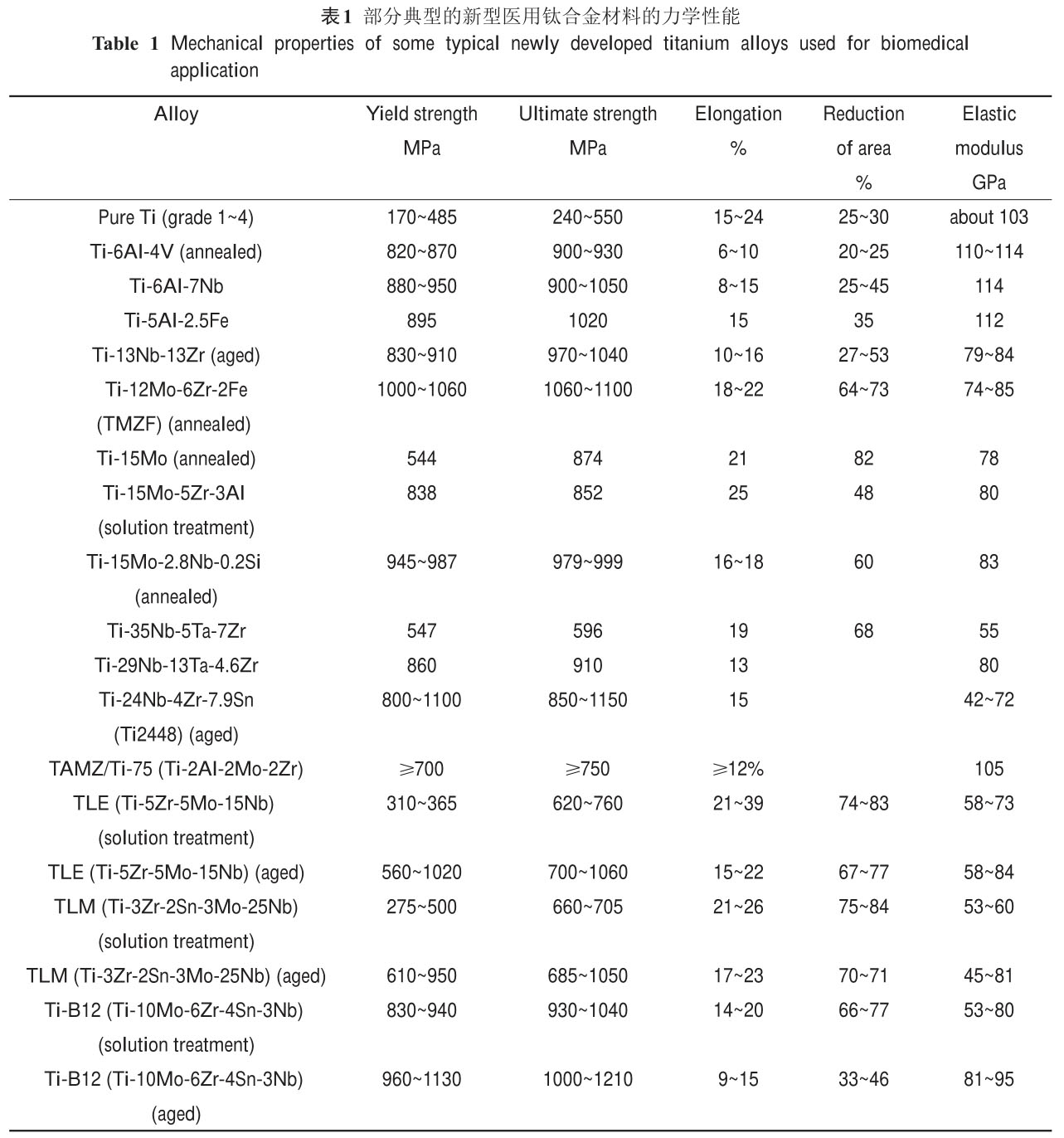
醫(yī)用鈦合金的典型力學(xué)性能如表1所示。
2����、 合金物理冶金學(xué)研究
2.1 鈦合金物理冶金學(xué)研究概述
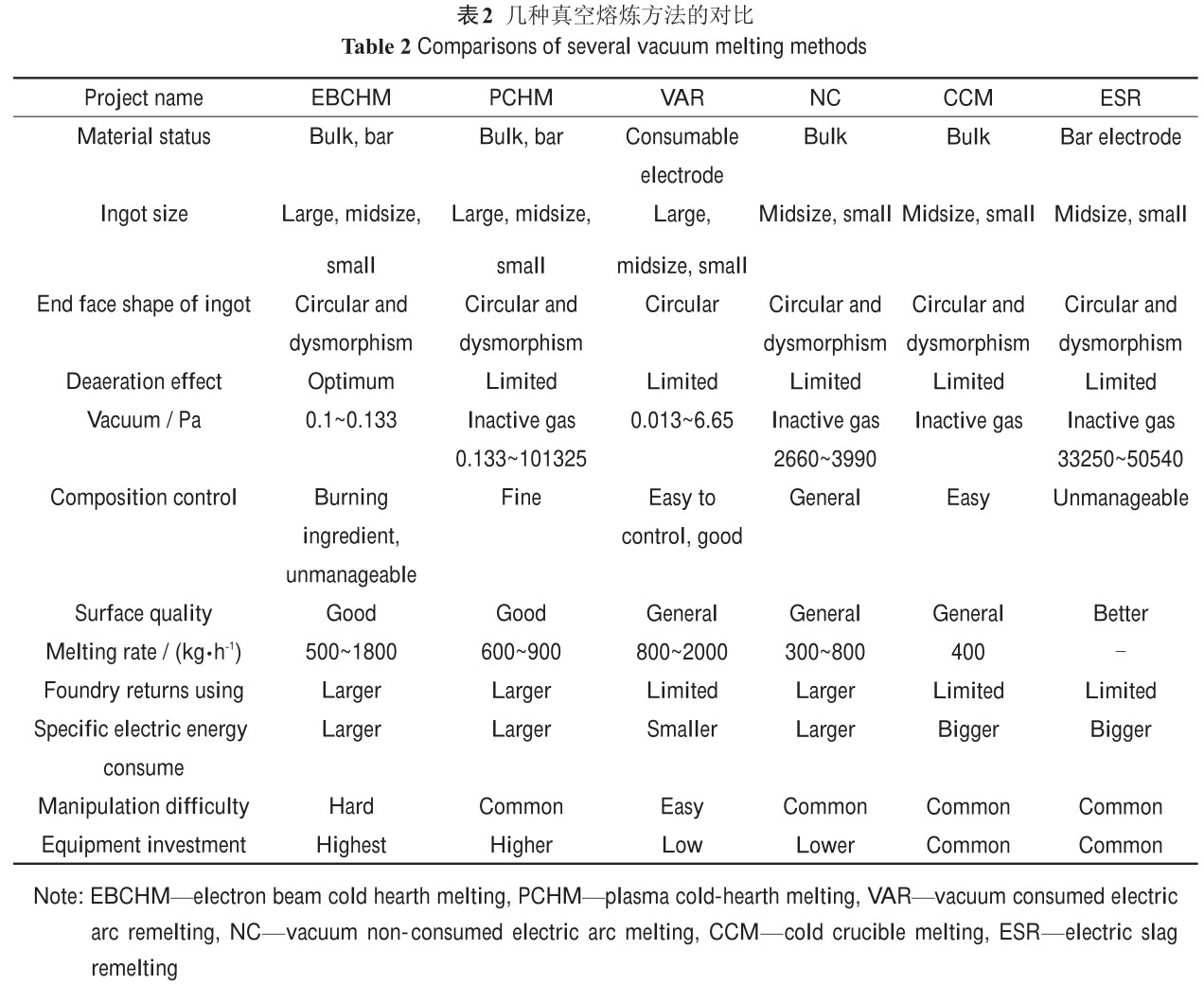
2.1.1 鈦合金的熔煉技術(shù)
鈦合金的熔煉技術(shù)主要包括真空自耗熔煉和真空非自耗熔煉 2 大類��。真空自耗熔煉設(shè)備主要包括:真
空自耗電弧熔煉(VAR)���、電渣熔煉(ESR)和真空凝殼爐熔煉(GRE);真空非自耗熔煉設(shè)備主要包括:真空非自
耗電弧熔煉(NC)�����、電子束熔煉(EBM)�、等離子束熔煉(PAM)等。其中 VAR 技術(shù)是工業(yè)鈦合金最常用的熔煉方
法���,對于一些要求高潔凈�、低夾雜等特殊用途的鈦合金材料也可采用 EBM�、PAM 等熔煉方法[38]。有關(guān)鈦合
金常用熔煉技術(shù)的工藝特點和參數(shù)對比如表2所示����。
2.1.2 鈦合金的凝固行為
VAR 過程中合金的凝固組織是由合金的成分及冷卻條件決定的,在合金成分確定之后�����,合金凝固組織主
要受傳熱條件控制。VAR 鈦合金鑄錠凝固組織一般包括 3 個晶區(qū)�,即表層的細晶區(qū)、鑄錠外側(cè)的柱狀晶區(qū)
及鑄錠中心的等軸晶區(qū)�����,而不同晶區(qū)晶粒的形貌將會影響最后鑄錠的性能[39~42]�����。合金凝固過程中容易發(fā)
生溶質(zhì)再分配���,而化學(xué)成分偏析是溶質(zhì)再分配的必然結(jié)果。宏觀偏析主要表現(xiàn)在鑄錠的內(nèi)外或上下各部位之
間的成分差異����,其中液相長程對流對合金中的宏觀偏析有重要影響。張利軍等[43]研究了高 Mo 含量β型鈦
合金鑄錠的偏析行為����,認為結(jié)晶偏析可通過Ti鑄錠尺寸規(guī)格控制、中間合金的種類選擇�����、熔煉次數(shù)和熔煉電
流的精確控制、成品鑄錠的均勻化處理工藝選擇等方法來進行預(yù)防���,從而獲得成分均勻性高��、沒有宏微觀偏
析的鈦合金鑄錠���,為后續(xù)的冷/熱壓力加工奠定了基礎(chǔ)。Sakamoto 等[44]和 Leder 等[45]對 α型�、α+β
型
和 β型等多種典型鈦合金在熔煉過程中合金元素分布的研究發(fā)現(xiàn):Cu在鑄錠橫截面上從鑄錠中心到邊緣含
量
逐漸減少,在鑄錠中心的含量最高�;Ni、Cr�、Fe、Mn與 Cu 有相同的偏析特征����,而 Mo 的分布與以上元素
相反。Ballantyne[46]通過研究合金元素 Al���、Fe�、Cr����、Ni�����、Si���、Zr、O��、N 在鈦合金鑄錠中的分布得到
了相同的宏觀偏析規(guī)律�。鄭亞波等[47]對大規(guī)格 TA13 鈦合金鑄錠Cu組元偏析控制研究發(fā)現(xiàn):在鑄錠的軸向
上區(qū)域����,由于熔煉后期補縮階段 Cu 元素的揮發(fā),導(dǎo)致鑄錠頂部的Cu含量相對較低����;在鑄錠內(nèi)部,Cu從鑄錠
中心到邊緣含量逐漸減少��,在鑄錠中心的含量最高����。趙永慶等[48]研究 Ti-2.5Cu、Ti-3Fe����、Ti-3Cr���、Ti-
13Cu-1Al和Ti-6Al-1.7Fe合金鑄錠中Cu、Fe和Cr的偏析規(guī)律發(fā)現(xiàn):合金元素Cu和Fe的偏析程度大�,Cr的偏析
程度小�����;Cu和Fe含量越高��,偏析程度越嚴重��;Cu 在 Ti-13Cu-1Al 的晶界處易發(fā)生富集���,而在 Ti-2.5Cu合
金中容易出現(xiàn)晶界貧化��。因此����,對于平衡分配系數(shù) K<1 的合金元素����,其從鑄錠中心到邊緣含量逐漸減少
�����,而對K>1的元素則相反[49~52]���。
2.1.3 鈦合金冶金缺陷形成及分析
鈦合金熔煉過程中冶金缺陷的形成與鑄錠組織中的白斑、樹環(huán)偏析等宏觀偏析密不可分����。1996 年
Kennedy等[53]將鈦合金鑄錠中的常見白斑分為 3 類,并根據(jù)假設(shè)形成機制命名�����。2002年Zhang等[54]研究
了INC-ONEL718合金在VAR鑄錠過程中枝晶白斑的形成����;Xu等[55]則利用有限容積方法(FVM)耦合元胞自動機
(CA)法研究了該合金中樹環(huán)偏析的形成����,并探討了VAR 過程中的工藝參數(shù)對樹環(huán)偏析的影響。宏觀偏析體現(xiàn)
在鑄錠內(nèi)外或上下部位之間的成分差異��,只有在溫度場、濃度場和流場耦合的基礎(chǔ)上�����,采用數(shù)值計算模擬才
可定量預(yù)測宏觀偏析�����。1997 年 Gar-tling和Sackinger[56]采用Parallel Virtual Machine soft-ware軟件
對TC4等鈦合金的VAR過程進行分析�����,得到 Al 元素的宏觀偏析及夾雜物的運動軌跡��。他們模擬了 TC4 鈦合
金 VAR 過程中 Al 元素和 V 元素在鑄錠上的分布����,以及有/無攪拌時O元素在鑄錠上的分布,證實電磁攪拌
可顯著減小鑄錠徑向的合金元素偏析��。另有研究[57,58]表明�����,電磁攪拌之所以能有效地減輕或消除中心偏
析��,一方面是通過控制熔體的流動方式,改變枝晶之間的熔體流動情況���;另一方面促進熔體填充因凝固收縮
所產(chǎn)生的孔隙�,控制游離晶體�。
經(jīng)真空自耗電弧熔煉的鑄錠,在鑄錠頭部��、中部�、晶界及枝晶間等地方,往往存在一些宏觀或顯微的收
縮孔洞��,容積大且集中的稱為縮孔��,細小而分散的稱為縮松�,其中在晶界或枝晶間出現(xiàn)的縮松又稱為顯微縮
松。任何形態(tài)的縮松或縮孔處都存在應(yīng)力集中��,這不僅會顯著降低鑄錠的力學(xué)性能����,而且在鑄錠開坯過程中
容易產(chǎn)生裂紋����。在后續(xù)深加工時縮松一般可以復(fù)合,但聚集有氣體和非金屬夾雜物的縮孔一般不能壓合而只
會伸長,更甚者會造成鑄錠沿縮孔軋裂或分層�,并在退火過程容易出現(xiàn)起皮、氣泡等缺陷��,從而降低產(chǎn)品的
表面質(zhì)量和成材率��。利用 Pro CAST 軟件可對鑄錠凝固后的縮松和縮孔進行計算數(shù)值模擬����,并可初步確定實
際鑄錠縮松和縮孔的位置[59]。
鑄錠熔煉過程的數(shù)值模擬是材料學(xué)��、物理學(xué)����、數(shù)學(xué)以及計算機圖形學(xué)等各學(xué)科的交叉,也是先進制造技
術(shù)的前沿��,開展鑄錠熔煉過程的數(shù)值模擬可以幫助工程技術(shù)人員優(yōu)化工藝參數(shù)����,縮短實驗周期,降低生產(chǎn)成
本并確保鑄錠的質(zhì)量�����。目前國外對于VAR 過程的數(shù)值計算已步入多物理場與多尺度耦合階段,對于深入理解
VAR 過程中熔體流動��、熱傳輸��、電磁作用����、微觀組織以及熔煉缺陷形成的物理化學(xué)現(xiàn)象具有重要意義。
2.2 部分醫(yī)用鈦合金的物理冶金新進展
2.2.1 生物醫(yī)用 Ti-Ta 合金
針對 Ti-xTa 合金設(shè)計開發(fā)方面���,國內(nèi)外學(xué)者開展了大量的研究����。Fedotov等[60]系統(tǒng)研究了Ti-Ta二元
合金高溫淬火發(fā)生的相變與成分的關(guān)系:隨著 Ta 含量增加���,依次產(chǎn)生 α'�����、α″、w���、β相���,且 β相
逐
漸增加����;當(dāng) Ta 含量超過65% (質(zhì)量分數(shù))時��,則全部轉(zhuǎn)變成 β相�。Zhou 等[61]對 Ti-Ta 二元合金的微觀
組織和力學(xué)性能進行了研究,發(fā)現(xiàn)淬火態(tài)的 Ti30Ta 和 Ti70Ta 合金的 Young's模量較低�����,分別為 69
和 67 GPa�,而對應(yīng)的抗拉強度分別為 587 和 600 MPa?�?梢?���,增加昂貴高熔點的Ta元素含量并不能顯著降
低合金的彈性模量,而抗拉強度也處于較低水平��。Margevicius和Cotton[62]對Ti-60Ta合金的研究發(fā)現(xiàn)�,合
金在拉伸過程中出現(xiàn)的屈服平臺是由于應(yīng)力誘發(fā)馬氏體相變引起的,在高溫淬火過程中有 w 相析出�,w 析
出相的體積分數(shù)隨熱處理溫度升高而增加�,并且 w 相的析出會阻礙β→α″馬氏體相變��。對鉭合金抗腐蝕
性
能的研究表明��,Ta2O5的穩(wěn)定性優(yōu)于TiO2�����,在兩者的共同作用下��,Ti-Ta合金具有很強的抗腐蝕能力��,有望在
生物醫(yī)學(xué)及石油化工工程等領(lǐng)域推廣應(yīng)用����。
本文作者所在課題組系統(tǒng)研究了 Ti-xTa (x=1、2��、5��、10��、20��、30、40�����、50�����、60�、80���,質(zhì)量分數(shù)���,%)二
元醫(yī)用鈦合金系列。選用1級小顆粒海綿Ti和冶金級Ta粉和混布料工藝�,采用三次VAR熔煉工藝制備出了成分
均勻、雜質(zhì)含量很低的優(yōu)質(zhì)合金鑄錠��。
2.2.2 生物醫(yī)用 Ti-Nb-Ta-Zr 合金
Niinomi等[1,9,20,63]在國際上最早研制開發(fā)了較低彈性模量的生物醫(yī)用 TNTZ亞穩(wěn)定 β 合金���。該合
金
在時效時會析出 α相或 w 相��,提高了合金的彈性模量�;而如果引入 β相及 α″相(馬氏體)���,或采用大塑
性變形會誘發(fā)馬氏體相變并產(chǎn)生微缺陷�����,從而可降低彈性模量��。TiNbTaZr四元系β型合金的彈性模量存在較
強的各向異性��,因而可通過控制軋制方向使其彈性量接近皮質(zhì)骨的水平���。
針對TNTZ合金中含有較多含量的Nb�、Ta等比金屬Ti熔點和密度都高得多的合金元素����,本文作者所在課題
組采用優(yōu)質(zhì)原料(小顆粒海綿Ti、冶金級Ta粉和Nb 粉��、海綿 Zr)��、混布料工藝�����、三次 VAR熔煉工藝,成功制
備出了成分均勻����、雜質(zhì)含量較低的優(yōu)質(zhì)合金鑄錠和熱軋板坯,有效避免了上述合金元素的宏觀偏析����。有關(guān)
TNTZ 鈦合金鑄錠��、熱軋板坯及其高低倍組織如圖1所示��。

2.2.3 抗菌用Ti-Cu合金
鈦合金作為一類生物惰性材料����,自身不具備抗菌或抑菌生物性能,當(dāng)植入人體后會與機體組織產(chǎn)生異物
排斥而誘發(fā)炎癥��,且有可能帶入有害細菌而引發(fā)感染����。研究[64]發(fā)現(xiàn),在現(xiàn)有醫(yī)用鈦合金中適量加入Cu����、Ag
等合金元素,可使鈦合金在保證其基本力學(xué)性能的同時,具有一定的廣譜殺菌或抑菌功效�����,從而有望成為一
種有效解決鈦合金外科植入器械細菌感染問題的新途徑��。本課題組采用合適的原料(0~1 級海綿 Ti 和
99.99%Cu 屑)和混布料工藝�����,設(shè)置合適的熔煉工藝參數(shù)����,通過反復(fù)多次熔煉和熱加工,成功制備出了
Ti3.5Cu 抗菌用鈦合金優(yōu)質(zhì)鑄錠和高品質(zhì)小規(guī)格棒材���。Ti3.5Cu合金宏觀形貌和顯微組織如圖2所示���,棒材表
面無可見的冶金缺陷和氧化皮,直線度和圓度良好����;由其顯微組織分析可見 α相呈扁平針條狀并均勻分布
。

2.2.4 口腔用Ti-Zr系鈦合金
Ti-Zr系鈦合金生物相容性好��,強度及塑韌性適中,是一類適合牙種植體��、義齒支架等齒科用產(chǎn)品設(shè)計
開發(fā)的新型醫(yī)用合金����。本課題組采用傳統(tǒng)的VAR熔煉技術(shù),成功制備出了成分較均勻�、雜質(zhì)含量較低的Ti-
xZr (x=1、2��、16�、20���、35��、50�、60�,質(zhì)量分數(shù),%)系列新型生物醫(yī)用鈦合金���,Ti-Zr系鈦合金實測化學(xué)成分
見表3����。
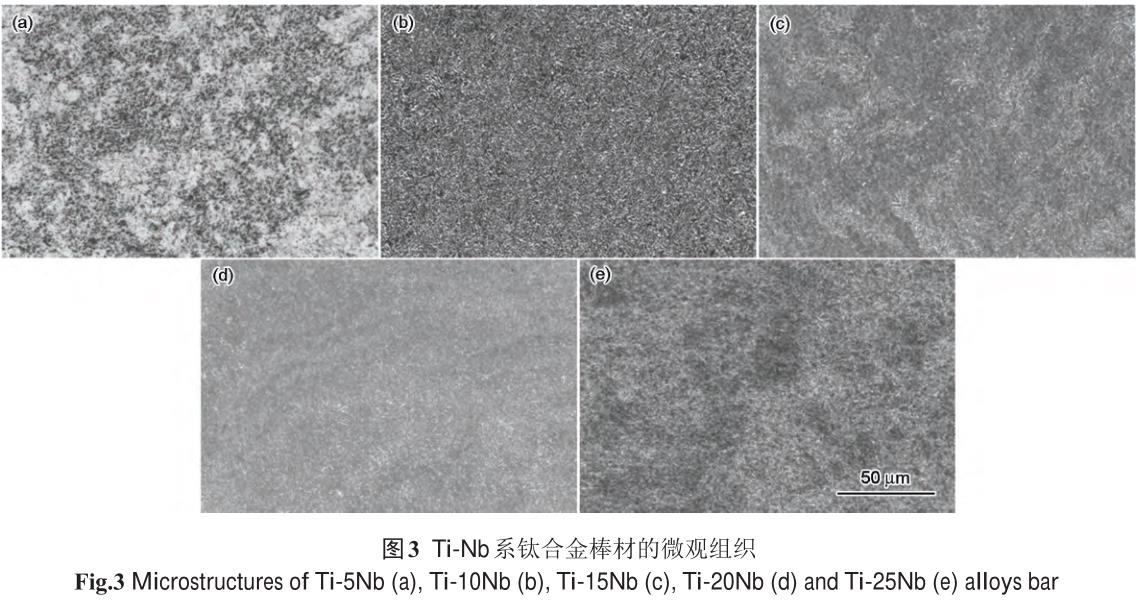
2.2.5 牙種植體用 Ti-Nb 系鈦合金
Hamzah等[65]研究發(fā)現(xiàn) Ti35Nb 合金具有一定的形狀記憶效應(yīng),其固溶態(tài)合金在拉伸時可恢復(fù)應(yīng)變僅為
0.5%����,但 經(jīng) 400 ℃ 、10 min 時 效 后 可 恢 復(fù) 應(yīng) 變 增 加 到3.25%����。研究還發(fā)現(xiàn),合金低溫時效會
形成細小的具有bcc結(jié)構(gòu)的析出相并導(dǎo)致較高的屈服強度和脆性���;550 ℃以上高溫時效時則會產(chǎn)生彌散分布
的針狀 α相�,屈服強度及斷裂延伸率分別達到 310 MPa和6%��。Inamura等[66]研究了Ti-xNb二元合金的形狀
記憶效應(yīng)和超彈性���,結(jié)果表明:Nb 含量增加 1% (原子分數(shù))則馬氏體轉(zhuǎn)變開始溫度(Ms)降低 43 ℃����;Ti-
(22~25)Nb合金經(jīng)900 ℃���、30 min固溶處理后具有形狀記憶效應(yīng)��;Ti-(25.5~27)Nb 合金呈現(xiàn)室溫超彈性�����,完
全可恢復(fù)應(yīng)變約 2%�����;當(dāng)經(jīng)過 300 ℃時效處理 1 h后可析出細小彌散的 w 相并因此增強了其超彈性�;經(jīng)過
冷軋后中溫退火(600 ℃、10 min)和時效處理(300 ℃���、1 h)����,合金的超彈性得到增強����。
本文作者所在課題組開展了 Ti-xNb (x=5�、10、15���、20�、25�����,質(zhì)量分數(shù),%)新型醫(yī)用鈦合金成分設(shè)計����、
熔煉及熱加工等基礎(chǔ)研究,其Ti-xNβ鈦合金棒材微觀組織如圖3所示����。
3 、合金加工制備����、微觀組織與力學(xué)性能研究
控制不同合金元素及其配比會形成不同類型的醫(yī)用鈦合金,而相結(jié)構(gòu)和顯微組織的形成與演變又離不開
其后續(xù)的加工���、熱處理等加工制備方法和具體工藝���,然后才能通過不同顯微組織或微觀變形機制來研究和提
高其綜合力學(xué)性能。因此���,除了宏觀上要關(guān)注高熔點的b-Ti穩(wěn)定元素及其含量配比對微觀組織的主要影響因
素外�,還必須從微觀層面關(guān)注O�����、N等雜質(zhì)元素對α'、α''�����、w相等中間相的形成以及這些中間
相
的結(jié)構(gòu)類型�、形貌、尺寸��、分布��、體積分數(shù)���、顯微織構(gòu)等因素及其對鈦合金彈性模量等力學(xué)性能的影響�,從
而使合金強度�、模量和塑韌性等綜合力學(xué)性能達到優(yōu)良匹配�����。
3.1 醫(yī)用鈦合金材料的加工制備
3.1.1 醫(yī)用鈦合金材料加工制備技術(shù)概述
任何新型的醫(yī)用鈦合金材料設(shè)計定型后��,只有易加工成不同形狀和規(guī)格的板��、管、棒���、條等常規(guī)材料����,
才能滿足不同外科植入物產(chǎn)品的后續(xù)精密加工需要�����。鈦合金板�、棒、管���、鍛件等半成品坯料首先需要采用高
溫(通常在合金相變點以上)大塑性變形以充分破碎原始的粗大鑄態(tài)組織�����,而常用的熱壓力加工設(shè)備或方法主
要包括自由鍛造�����、精密鍛造�����、快速鍛造等�。目前市場上常用的鈦合金外科植入物及矯形器械產(chǎn)品,其精密加
工所用的原材料主要為小規(guī)格的板�����、管��、棒�����、線�、絲、箔等深加工產(chǎn)品����,采用擠壓、軋制�、旋鍛、拉拔等4
種加工方式即可獲得�。
3.1.2 醫(yī)用鈦合金材料的先進加工制備研究
(1) 大塑性變形加工和晶粒微納米化處理
與粗晶材料相比��,具有微納米結(jié)構(gòu)的超細晶材料(在其晶體區(qū)域或其它特征長度的典型尺寸至少在一維
方向上達到 100 nm~1 mm)往往具有優(yōu)良的理化特性�,一般具有較高的強度�����、硬度�、疲勞壽命和低溫超塑性
�����、高應(yīng)變速率以及優(yōu)良的切削性能等綜合力學(xué)性能����,部分材料還具有良好的熱穩(wěn)定性、耐蝕性����、耐磨性和生
物學(xué)性能等。目前加工超細晶金屬材料主要包括物理沉積�、快速凝固、非晶晶化�、機械合金法以及強力大塑
性變形的擠壓、軋制��、拉拔等方法�。其中,強塑性變形法(SPD,主要包括等徑角擠壓(ECAP)��、累積復(fù)合軋制
(ARB)等)憑借其強烈的細化晶粒能力����、不易引入微孔和雜質(zhì)以及可以制備較大尺寸塊狀樣品等優(yōu)點已引起廣
泛關(guān)注,該方法為傳統(tǒng)醫(yī)用金屬材料力學(xué)性能的優(yōu)化升級指明了一條新方向����,也是解決目前醫(yī)用純Ti強度低
、模量高��、生物力學(xué)性能欠佳等問題的最佳途徑�����。
目前在超細晶金屬材料的基礎(chǔ)研究及產(chǎn)業(yè)化方面的領(lǐng)軍人物是烏法國立航空技術(shù)大學(xué)先進材料物理研究
所(IPAM USATU�,Ufa,Russia)的 Ruslan Va-liev教授帶領(lǐng)的團隊�����,2002年他在《Nature》上發(fā)表了生物醫(yī)
用納米 Ti 的研究進展[67]�����,2006 年對納米純 Ti棒進行了商業(yè)化應(yīng)用,2007 年成立了 NanoMet LLC公司
����,目前年生產(chǎn)能力達2 t����,可制備出直徑4~8 mm、長3 m的長棒���,精度級別為H8級�����。該超細晶高強純Ti 材料
分別于 2006 和 2011 年被捷克 Timplant 公司(商標(biāo)號:Nanoimplant)和美國 BASIC Dental Implant
Systems公司(商標(biāo)號:Biotanium)用于牙種植體的制造�,并分別取得產(chǎn)品注冊證[68,69]�。2012年超細晶高
強純Ti材料申請納入了ISO9001:2008標(biāo)準(zhǔn)。
國內(nèi)在超細晶純 Ti 研究方面的領(lǐng)軍人物是南京理工大學(xué)朱運田等[70,71]���,其在超細晶高強度和粗晶
大塑性變形方面提出了新思路�����,研制出了一種以高強度的超細晶“硬”層片為基體并彌散分布著大塑性再結(jié)
晶“軟”層片的全新微觀結(jié)構(gòu)��,其外科植入物用超細晶純Ti的加工技術(shù)于2002年獲得美國專利(U.S. Patent
No. US6399215 B1����,4 June 2002),具體制備方法為:首先對直徑 26 mm����、長 120 mm 的短棒和模具進行
450 ℃退火,然后采用 50%道次變形量進行ECAP制備���,得到了直徑16 mm的棒材����,其原始晶粒尺寸為 10 mm
��,擠壓角為 90°�����,共進行 8 道次后����,平均晶粒尺寸為 260 nm,抗拉強度從 460 MPa 提高至710 MPa����,屈
服強度從 380 MPa 提高至 640 MPa����,延伸率為 14%���;然后再對直徑 16 mm 的棒材進行總變形量為 55%的冷
軋后,其抗拉強度達到 1050 MPa���,屈服強度1020 MPa����,延伸率6%�,斷面收縮率30%[71]。
2013 年�����,本文作者所在課題組[72]采用累積大變形 冷 軋 技 術(shù) ��,加 工 獲 得 直 徑 0.5~20 mm 的
TC4�、TC4ELI 2 種醫(yī)用鈦合金細晶化的棒、線材�,晶粒組織評級均達到A1級���,其強度和塑性指標(biāo)均優(yōu)于同種
工業(yè)化粗晶態(tài)的鈦合金材料。隨后�����,該研究團隊采用改進的 ARB 法-累積包覆疊軋自有技術(shù)�����,對新型高強低
模量β鈦合金TLM超細晶板��、箔材進行了加工制備��、微觀組織及其力學(xué)性能的系統(tǒng)研究�。研究[73]發(fā)現(xiàn),隨
著
復(fù)合層數(shù)的增加�,超細晶薄板內(nèi)部位錯密度增加,超細晶粒所占比率增多��,屈服強度����、抗拉強度、表面硬度
逐漸增大��,彈性模量總體呈上升趨勢。其中 8 層薄板材料內(nèi)部均勻分布著晶粒尺寸約為100 nm且被明顯晶
界包圍的超細晶粒�,其抗拉強度達到最大值 1200 MPa,比單層冷軋態(tài)薄板提高49%����;而 16 層復(fù)合板內(nèi)部充
滿了超細晶組織,平均晶粒尺寸約為 50 nm�;當(dāng)復(fù)合加工的箔材厚度為0.06 mm時,抗拉強度達到1050 MPa
�����,而此時的彈性模量低至 35 GPa[74]���。有關(guān)超細晶 TLM 鈦合金箔材的實測力學(xué)性能如表 4 所示。另外��,
針對某骨科器械對鈦合金箔材的需求�,他們選用厚度為 2 mm 的TLM板材,采用傳統(tǒng)的冷軋技術(shù)和超大累積
變形量(98%)�����,通過優(yōu)化道次變形量����、潤滑劑��、低溫消除應(yīng)力處理等工藝參數(shù)�����,解決了鈦合金箔材的冷變形
難��、表面褶皺或鼓包等技術(shù)難題��,研制出厚度0.02 mm���、寬
度大于 200 mm、長度可達幾十米的具有高強度�����、低模量和超彈性的TLM鈦合金超細晶優(yōu)質(zhì)箔材��,并獲國家發(fā)
明專利(ZL201310660898.0)��。
(2) 多孔化制備及微孔結(jié)構(gòu)控制
近年來臨床應(yīng)用研究[75]發(fā)現(xiàn)�,傳統(tǒng)的 Ti 及鈦合金因其彈性模量與骨相比仍較高,可產(chǎn)生“應(yīng)力屏蔽
或遮擋”現(xiàn)象,在這種應(yīng)力條件下�,缺少足夠應(yīng)力刺激的骨組織會出現(xiàn)退化。而工業(yè)上批量化生產(chǎn)的醫(yī)療器
械的外形輪廓及三維結(jié)構(gòu)與病患骨組織貼合度欠佳�����,也進一步加劇骨組織萎縮��、甚至被吸收�,最終導(dǎo)致植入
體失去臨床康復(fù)治療效果。
為增強植入體與骨組織之間的相容性����,加速骨整合,研究人員提出了在材料內(nèi)部引入孔隙的方法�����,即將
其制成整體多孔材料���。與致密材料相比,多孔鈦合金的強度和彈性模量明顯下降�����,并且其密度、強度和彈性
模量可以通過對孔結(jié)構(gòu)的調(diào)整來達到與被修復(fù)替換骨組織的力學(xué)性能相匹配��;另外���,在多孔 Ti 的應(yīng)力-應(yīng)
變曲線中�,彈性變形后有一個較長的應(yīng)力平臺����,能夠?qū)ν鈦頉_擊力起到緩沖、減震和抗沖擊的作用�����,這對人
體承載部位的應(yīng)用有重要的意義[76~78]��。并且多孔Ti材料獨特的多孔結(jié)構(gòu)及粗糙的內(nèi)外表面將有利于成骨
細胞的黏附��、增殖和分化���,促使新骨組織長入孔隙���,使植入體同骨之間形成生物固定,并最終形成一個整體
[79~84]�。此外多孔鈦合金材料具有獨特的三維連通孔,能夠使體液和營養(yǎng)物質(zhì)在多孔植入體中傳輸,促進
組織再生與重建�����,加快愈合過程[85~88]�����。
多孔金屬材料已成為當(dāng)今國內(nèi)外生物材料研究的熱點之一��。目前��,鈦合金多孔材料制備技術(shù)主要包括液
相���、固相和金屬沉積3類方法�,其中以固相法中的粉末冶金法(PM)研究最多�,粉末燒結(jié)的發(fā)泡物一般是 NaCl
、TiH2��、碳酸氫胺等常用材料���,也有嘗試用 Mg 等新材料作為發(fā)泡填充物[89]。Zimmer (捷邁)公司采用氣
相沉積制備的全球第一個商品化的醫(yī)用多孔Ta材料(骨小梁金屬)已用于人體皮質(zhì)骨和和松質(zhì)骨修復(fù)[90]���,其
產(chǎn)品如椎體替代物���、髖臼填充塊�、股骨頭壞死重建棒等已面世���。但該方法具有以下缺點:含有 1%的碳類雜
質(zhì)致使產(chǎn)品的塑性較差���、需要制備玻璃或碳骨架(結(jié)構(gòu)復(fù)雜難于制作大尺寸材料)、生產(chǎn)周期較長且成本較高
���。國內(nèi)重慶潤澤公司采用反模造孔-高溫高真空燒結(jié)的方法也制備出了
性能較好的多孔Ta材料[91]��。
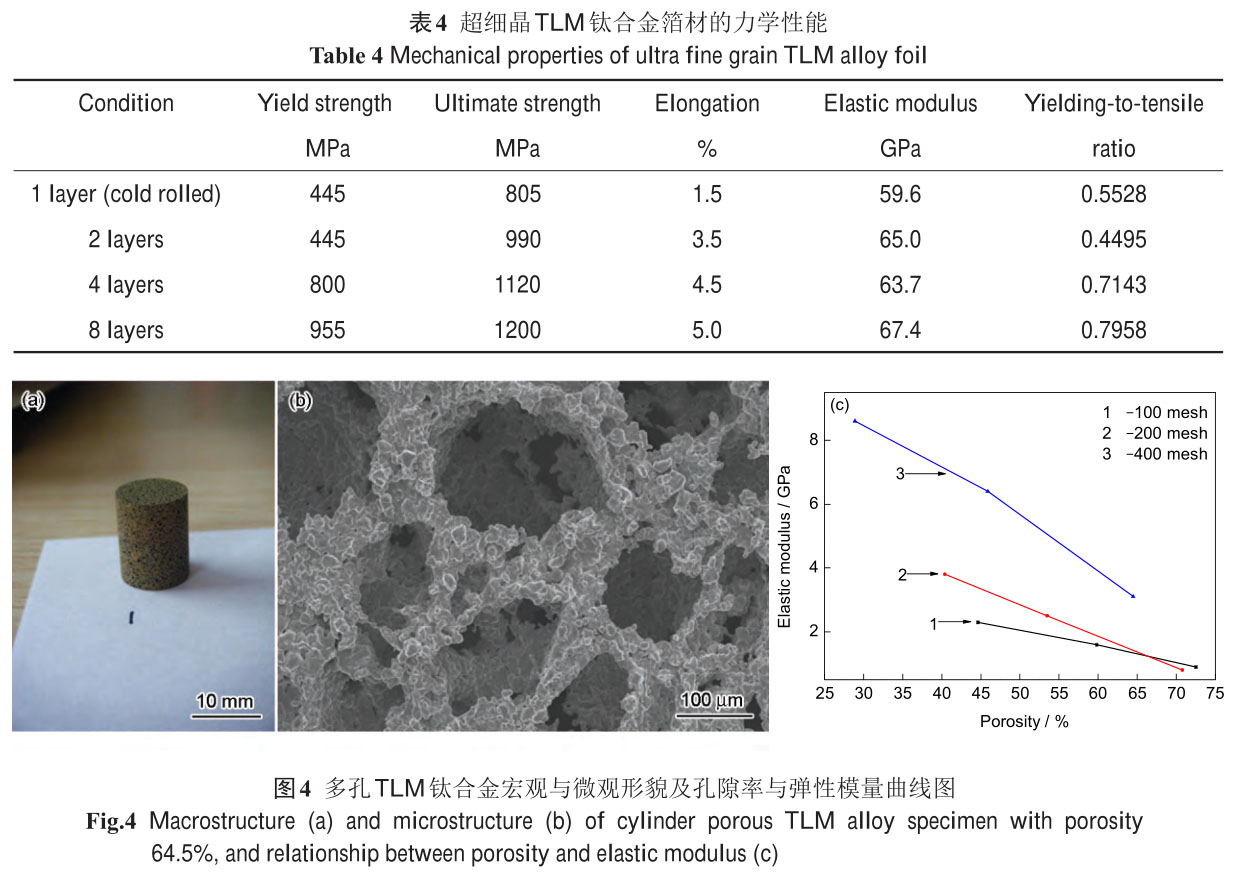
本文作者所在課題組通過粉末冶金法制備出了與 3 種預(yù)期孔隙率(30%�����、50%和 70%)相近的新型多孔
TLM 鈦合金���,如圖 4a 和 b 所示。研究發(fā)現(xiàn)��,當(dāng)孔隙尺寸為50~600 mm時�,其孔洞分布和成分均勻�、三維貫
通性好�����,且孔的內(nèi)壁表面粗糙并伴有微孔分布��;多孔Ti的比表面積隨著孔隙率的增加而增大�,有利于提高成
骨細胞的吸附能力和促進骨細胞的長入,可更好地保證其生物活性并利于生物固定��;在基體金屬粒度為
38~150 mm 時�����,多孔 Ti 孔隙的結(jié)構(gòu)特征和孔洞尺寸的大小主要由造孔劑決定�;在 1100~1300 ℃范圍內(nèi),
隨著燒結(jié)溫度的升高�,孔洞形狀更規(guī)則,尺寸分布趨向均勻��。多孔TLM鈦合金的力學(xué)性能主要受孔隙率大小
的影響:研究發(fā)現(xiàn)�,隨著孔隙率的提高,多孔材料的壓縮強度和彈性模量急劇下降(圖 4c)�����;粉末粒度對多
孔材料的屈服強度和彈性模量也有一定的影響�����,在相同孔隙率下��,粉末越細��,多孔材料的力學(xué)性能越好��;在
相同粉末粒度和孔隙率下���,與多孔純 Ti 相比�����,多孔 TLM 鈦合金具有高強度��、低彈性模量的特點����,如孔隙
率為 45.9% (38 mm)的多孔 TLM 鈦合金的屈服強度為 264 MPa��,彈性模量為 6.4 GPa�,與人骨中松質(zhì)骨的
力學(xué)性能相近�����,具有良好的生物力學(xué)相容性�����,在骨移植材料方面具有良好的應(yīng)用潛力����。
3.2 生物醫(yī)用鈦合金的顯微組織與力學(xué)性能控制
醫(yī)用金屬材料的微觀組織����、相轉(zhuǎn)變、力學(xué)性能及其微觀塑性變形機制與其加工��、熱處理過程控制關(guān)系密
切���。目前���,國內(nèi)外對新型醫(yī)用β鈦合金的組織與性能研究較多,主要因為此類合金不僅成分多元化�,并且
可通過不同加工和熱處理使合金呈現(xiàn)出多種相結(jié)構(gòu)和不同顯微組織,而滑移變形��、馬氏體轉(zhuǎn)變與孿生變形是
β鈦合金較常見的微觀塑性變形方式。上世紀(jì) 80 年代研究人員展開β鈦合金的組織與性能關(guān)系的基礎(chǔ)研
究[20]�,圍繞其低模量、超塑性和低屈服應(yīng)力等現(xiàn)象�,先后得出了馬氏體相變����、孿生控制、無位錯變形等多
種不同微觀塑性變形機制����。
目前,國內(nèi)外學(xué)者的相關(guān)研究大多集中于固溶和時效工藝對鈦合金組織中無熱w相及等溫w相的形成����、a
相的形成過程、a′馬氏體及其轉(zhuǎn)變過程��、變形誘發(fā) w 相或 α″以及 w 相對 β→α 轉(zhuǎn)變的影響����。對TiMo
合
金的研究[92]表明,Mo 含量為 10%時固溶淬火后的顯微組織為 β+α″相����;Mo 含量為 15%和 20%時變?yōu)閎+
納
米級w相��,且隨Mo含量的增加�,w相的尺寸更?��?;同時隨著Mo含量的增加����,抗拉強度分別為 756、739 和 792
MPa�,延伸率分別為 24%、29%和2%����。郝玉林等[93]研究發(fā)現(xiàn),Ti29Nb13Ta4.6Zr合金經(jīng)β相區(qū)固溶后于400
℃
以下低溫時效��,導(dǎo)致高的拉伸強度和疲勞壽命���,這歸功于時效形成的細小 α 和 w相�����,在這個溫度時效的合
金 Young's 模量可從 100GPa 減少到 60 GPa��。這與 Miura等[94]研究的 TiNbSn及Ti-Nb β鈦合金結(jié)
果
基本一致����。但卻與一般研究認為的w 硬脆相只能提高合金的彈性模量相反。有研究[35]表明�,合金經(jīng)固溶形
成的無熱 w 相和 400 ℃以
下時效形成的等溫 w 相導(dǎo)致其合金 Young's 模量增大。也有認為�����,亞穩(wěn)β鈦合金在 α 鼻溫和馬氏體
相變點間的溫度時效后����,可誘發(fā)等溫w相的形成�����,且w相能給條狀α相提供很好的形核地點�����。有關(guān)是否w相顆
粒
自身轉(zhuǎn)變成為條狀 α 或 w/b 界面的條狀 α相仍有不同觀點��,但 Ohmori 等[95]與 Mantani 等[96]通過
對
不同亞穩(wěn)β鈦合金的研究均證實了w相顆粒轉(zhuǎn)變成條狀α相的證據(jù)。
Hanada和Izumi[97]研究發(fā)現(xiàn)��,Ti-(11~18)Mo合金通過冷軋變形導(dǎo)致了w相的形成����。為此,Zhao等[98]及
Nakai 等[99]研究脊柱內(nèi)固定器用 β型鈦合金 Ti-(15~18)Mo 時����,通過變形誘發(fā) w 相變提高了合金的彈性
模量,同時發(fā)現(xiàn)應(yīng)力誘發(fā)的 w 相變伴隨{332}b機械孿晶的產(chǎn)生���,從而使合金保持適當(dāng)塑性的同時強度提高
�,尤其是Ti17Mo合金的彈性模量變化范圍最寬并容易發(fā)生彎曲�,且易達到脊柱固定器所要求的形狀。Nakai
等[100]也通過彎曲和冷軋使合金組織發(fā)生應(yīng)力誘發(fā) w相變�����,從而使 Ti12Cr 合金具有自身調(diào)節(jié)其彈性模量
的功能���,即在手術(shù)時通過對合金局部區(qū)域進行彎曲變形來獲得高的彈性模量�����,而不變形區(qū)域 的 彈 性 模
量 保 持 不 變 �。 Niinomi 等[101] 在 研 究TNTZ 自調(diào)節(jié)模量鈦合金方面,發(fā)現(xiàn)抑制無熱 w 相變可提高
變形誘發(fā) w相變的增加����,從而導(dǎo)致合金模量提高,進而提高脊柱固定器的彎曲性能�����;另外還發(fā)現(xiàn)劇烈的冷加
工變形和時效���、控制少量的 w相能夠
在保持低模量和良好塑性的同時,提高疲勞強度���,且控制TNTZ中w相的含量�,使彈性模量低于80 GPa�。
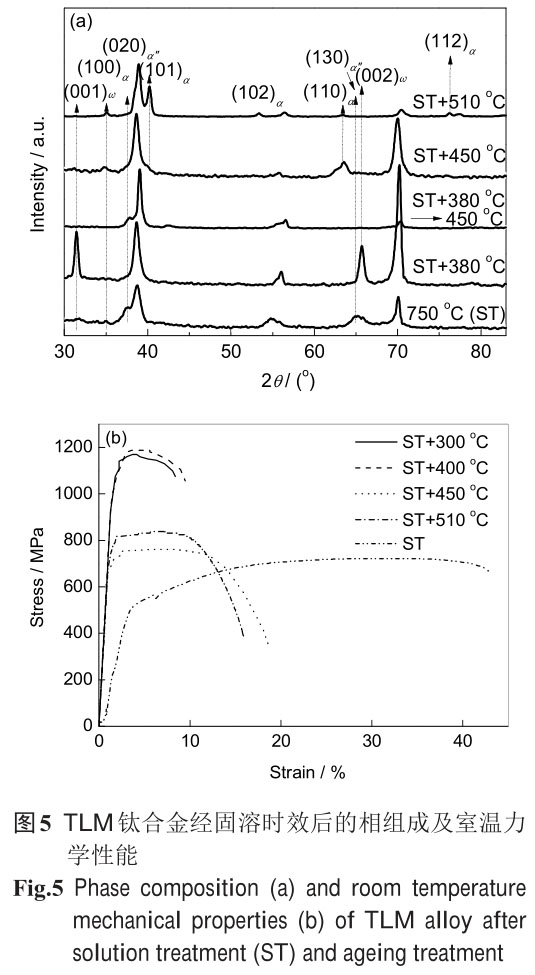
本文作者所在課題組[102,103]對 TLM 鈦合金的研究表明,固溶后的顯微組織為 β相和少量細長的 a
″相�����,合金經(jīng)低溫300~500 ℃時效的過程中��,α相的形成經(jīng)歷了 b→w→a 和 α"→a 的 2 個相轉(zhuǎn)變過程,
微觀組織揭示出 α"馬氏體對亞穩(wěn) w 相的形成具有一定的阻礙作用�。其中固溶處理后的的合金表現(xiàn)出低模
量、適當(dāng)?shù)膹姸群蛢?yōu)良塑性����,而在300~380 ℃長時間時效后獲得不同尺寸及分布的 w 相顆粒,其彈性模量
比固溶處理的合金模量降低了 20 GPa 左右�����;但當(dāng) w 相長大到一定尺寸或 α相即將形成階段����,合金彈性模
量反而增大。TLM 合金經(jīng)大變形冷軋后還發(fā)現(xiàn)�,其軋制方向的彈性模量降低,其原因主要是應(yīng)力誘發(fā) α"馬
氏體轉(zhuǎn)變引起的織構(gòu)演化所致���,而強度提高的原因是馬氏體演變過程中高密度位
錯的形成及晶粒細化至納米尺寸所致��。研究發(fā)現(xiàn)����,影響鈦合金彈性模量 E 的貢獻率按相結(jié)構(gòu)依次大體為
w>a'>a>b≈α"�,冷加工誘發(fā)的塑性變形或應(yīng)變對 E 值影響很?��。欢鴮ζ滹@微硬度影響程度
按相結(jié)構(gòu)依次大體為 w>a'>a>b>α"����。鑒于此,首先利用介穩(wěn)定β鈦合金 TLM 高溫固溶
處理形成介穩(wěn) β相或馬氏體 a'�����、α"等中間相(過渡相)����,然后利用其低溫時效分解形成次生 α相、w
相等二次析出相���,或利用介穩(wěn) β相的二次變形產(chǎn)生的應(yīng)力誘發(fā)馬氏體(或?qū)\晶),就可能實現(xiàn)其彈性模量���、
抗拉強度等綜合力學(xué)性能的優(yōu)良匹配調(diào)控���。有關(guān) TLM 鈦合金在固溶時效后的顯微組織演化規(guī)律及典型力學(xué)
性能如圖5所示。
4 �����、應(yīng)用研究及評價
進入21世紀(jì)以來,以鈦合金為代表的生物醫(yī)用材料以其優(yōu)良的綜合性能一直是臨床應(yīng)用中量大面廣的重
要產(chǎn)品����,正在成為全球新興的支柱產(chǎn)業(yè),也是世界新材料領(lǐng)域發(fā)展的重點���。雖然近 20 年來我國在鈦合金等
醫(yī)用金屬材料及其醫(yī)療器械等產(chǎn)品的研發(fā)����、生產(chǎn)和應(yīng)用等方面取得了長足進步���,但在整體的科技水平����、產(chǎn)業(yè)
化技術(shù)和市場應(yīng)用等各方面與歐美日等發(fā)達國家相比仍存在較大差距����,亟需加強對醫(yī)用鈦合金材料的生物學(xué)
、生物力學(xué)�����、表面功能改性、先進制造技術(shù)的基礎(chǔ)理論和應(yīng)用技術(shù)研究�,從而促進我國鈦合金醫(yī)療器械的研
發(fā)、應(yīng)用和推廣����。
4.1 醫(yī)用鈦合金材料的應(yīng)用概述
上世紀(jì)50年代,科研人員用鈦股骨頭植入假體進行體內(nèi)植入實驗�����,證實骨可以長入鈦合金假體[104]�。
上世紀(jì)60年代末,瑞典學(xué)者Branemark在兔子體內(nèi)植入鈦發(fā)現(xiàn)“骨整合”現(xiàn)象并在 1971 年成功開發(fā)出牙種
植體系統(tǒng)[105]����,給大量牙缺失患者帶來了福音。
1961年英國骨科醫(yī)生Charnley開發(fā)了第一個低磨損全髖金屬關(guān)節(jié)并成功植入體內(nèi)�����,治愈了大量骨性關(guān)節(jié)
炎患者[106]����。截至目前�,我國納入《外科植入物和矯形器械目錄》中所涉及的醫(yī)械產(chǎn)品包括骨與關(guān)節(jié)替代
物�、骨接合植入物�、脊柱植入物、心臟和血管植入物�����、顱骨修復(fù)植入物���、齒科植入物及手術(shù)器械等7大類合
計約1000種�,其中所用金屬材料均以Ti及鈦合金為主��。上述金屬器械除了接骨板及配套接骨螺釘和手術(shù)器械
等承力小且術(shù)后或 2 a 內(nèi)要拆卸取出的部分低端器械產(chǎn)品(屬 1~2 類)外���,人工關(guān)節(jié)����、牙種植體��、脊柱內(nèi)固
定系統(tǒng)等大量3類高端軟��、硬組織修復(fù)和替代類金屬器械則需要永久留存于人體內(nèi)部各個部位����。
我國第一個國家標(biāo)準(zhǔn)《外科植入物用鈦及鈦合金加工材���,GB/T13810-1992》自 1992 年頒布實施后已經(jīng)
2 次換版,但目前仍只有純 Ti (中國牌號 TA1(TA1ELI)~TA4���,美國對應(yīng)牌號 Gr1~Gr4)��、Ti6Al4V(中國牌號
TC4��、TC4ELI����,美國對應(yīng)牌號 Gr5 或 Ti64)和 Ti6Al7Nb (中國牌號 TC20) 3 大類鈦合金材料允許批量化生
產(chǎn)和市場應(yīng)用�,尚沒有一個新型 β型鈦合金納入國家標(biāo)準(zhǔn)。2010年我國生產(chǎn)銷售的醫(yī)用純Ti 及 TC4 鈦合
金材料已達到 1084 t���,其中出口約占20%����。截止目前純Ti和TC4鈦合金仍是國際上應(yīng)用最廣的外科植入物專
用材料�,但國產(chǎn)醫(yī)用鈦材由于品質(zhì)欠佳、尺寸精度不高等原因而主要用于中低端醫(yī)療器械產(chǎn)品(接骨板��、接
骨螺釘、外固定支架等)�,對于人工關(guān)節(jié)����、牙種植體、脊柱內(nèi)固定系統(tǒng)等高端醫(yī)療器械生產(chǎn)仍需大量進口國
外優(yōu)質(zhì)鈦合金原材料����。
國外在新型醫(yī)用鈦合金的開發(fā)應(yīng)用走在世界前列。1994年美國率先研制新型低模量化β型醫(yī)用鈦合金
Ti13Nb13Zr 且第一個被正式列入國際醫(yī)用標(biāo)準(zhǔn)[107]����,隨后美國又開發(fā)出 Ti12Mo6Zr2Fe (TMZF)亞穩(wěn)定 b
型鈦合金,2000 年被全球最大的骨科專業(yè)集團下屬的Strker公司用來制造髖關(guān)節(jié)假體系統(tǒng)的股骨柄����,并在
中國得到臨床應(yīng)用[108]。日本學(xué)者也發(fā)展了一系列具有高強度低模量和優(yōu)異生物相容性的Ti- Zr 系 合 金
如 TiZrNb����、TiZrNbTa、TiZrAlV���,其 中Ti30ZrxMo合金被認為是適用于可取出植入物的最佳材料�。
中國科學(xué)院金屬研究所楊銳、郝玉琳研究員研發(fā)團隊[109]研發(fā)出新型低模量化β型醫(yī)用鈦合金Ti2448
����,
并起草建立了 1 項材料企業(yè)技術(shù)標(biāo)準(zhǔn),先后獲得美國和中國專利授權(quán)��,采用該合金制作的骨科用接骨板和
脊柱固定系統(tǒng)2類植入器件已完成臨床實驗評價�����,威高骨科材料有限公司已向國家食品藥品監(jiān)督管理局申報
產(chǎn)品注冊證�,有望成為我國最早在生物
醫(yī)學(xué)工程領(lǐng)域獲得實際應(yīng)用的新材料。
2003 年��,本文作者所在課題組成功開發(fā)出了新型近 β型醫(yī)用鈦合金 TLM 并已先后取得多項國家發(fā)明
專利(ZL03153138.5)�。該新材料經(jīng)固溶處理后具有優(yōu)良的加工塑性,采用傳統(tǒng)壓力加工設(shè)備易加工成各種工
業(yè)用大���、中規(guī)格的板���、棒、管�、條、鍛件等常規(guī)產(chǎn)品���,以及小��、微���、細、薄等尺寸特殊的特種產(chǎn)品如超細絲
(直徑≥50 mm)�����、毛細管(直徑≥1 mm�����、壁厚≥0.1 mm)�、箔材(厚度≥20 mm)等,已起草建立了10 余項材料
企業(yè)技術(shù)標(biāo)準(zhǔn)�。TLM 鈦合金不僅力學(xué)性能變化區(qū)間寬廣,而且具有一定的超彈性�、記憶效應(yīng)等功能特性
[110],因而可滿足不同外科植入物產(chǎn)品對材料力學(xué)性能的設(shè)計要求��。該合金已被制作成牙種植體����、髖關(guān)節(jié)
��、顱骨修復(fù)網(wǎng)板����、髓內(nèi)釘���、脊柱內(nèi)固定系統(tǒng)���、各類接骨板及配套螺釘以及血管支架和心臟起搏器用外殼等各
類器械產(chǎn)品,目前與國內(nèi)外多所知名醫(yī)療��、科研機構(gòu)及醫(yī)械公司的生物醫(yī)學(xué)及臨床應(yīng)用研究評價等工作仍在
持續(xù)進行中�����。
4.2 醫(yī)用鈦合金材料的生物學(xué)及其相容性研究
4.2.1 醫(yī)用鈦合金材料的生物學(xué)評價概述
凡與人體接觸和植入或介入人體內(nèi)部的各類醫(yī)療器械原則上都存在一定的潛在風(fēng)險性�����。醫(yī)療器械和人體
之間的相互作用和影響的過程和規(guī)律非常復(fù)雜��,會在器械(施體)與機體(受體)之間發(fā)生組織�����、血液、免疫和
全身反應(yīng)等主要4種生物學(xué)反應(yīng)�����。而這些生物學(xué)反應(yīng)在臨床上也可能會出現(xiàn)以下并發(fā)癥:(1) 滲出物反應(yīng)����;
(2) 感染;(3) 鈣化�;(4) 血栓栓塞���;(5) 腫
瘤等[111]����。其中感染是外科植入器械在治療上最常見的主要并發(fā)癥之一�����,其發(fā)生率約為 1%~10%��。上世紀(jì)
80 年代末臨床醫(yī)生對 TC4 鈦合金人工髖關(guān)節(jié)實施翻修手術(shù)時�����,已經(jīng)發(fā)現(xiàn)其假體周圍骨組織有致炎感染和黑
化現(xiàn)象,而其表面狀態(tài)欠佳諸如耐磨性差或外加涂層脫落�����、降解等也會導(dǎo)致植入體與骨組織之間不能實現(xiàn)化
學(xué)緊密結(jié)合等���。另外 TC4 鈦合金
較高的彈性模量 E (約 110 GPa)與低模量的自然骨(5~30 GPa)之間的彈性不匹配可引起骨吸收�����、骨萎縮等
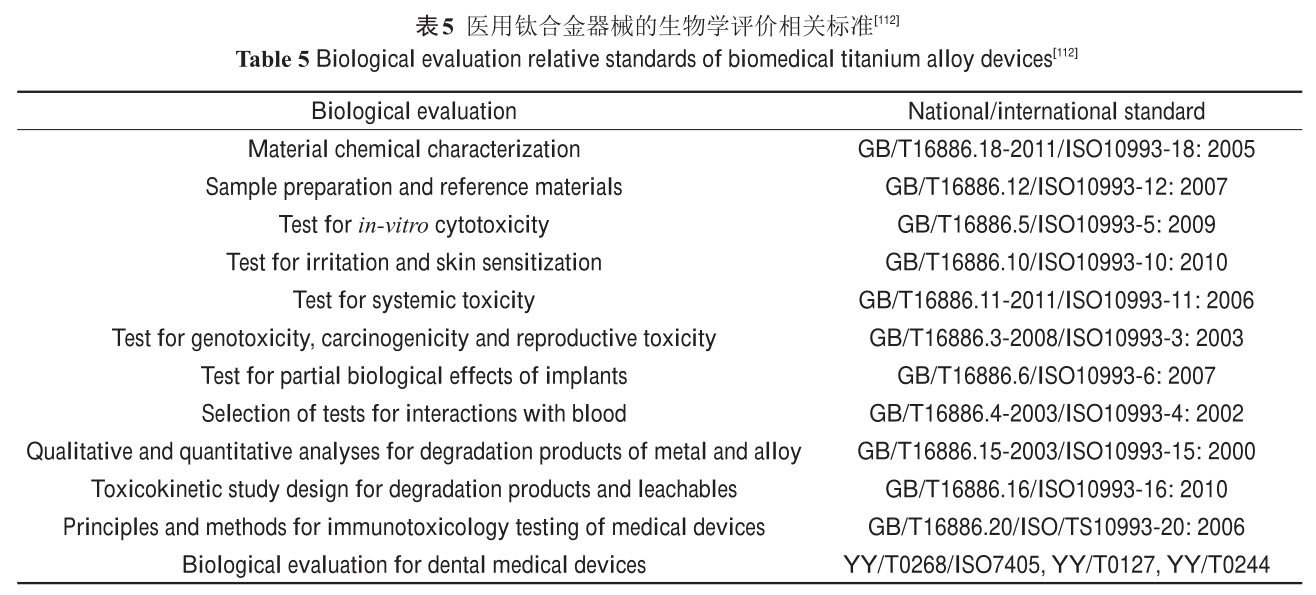
一系列并發(fā)癥���。因此,它們在應(yīng)用于臨床前都必須進行一系列的生物學(xué)研究和評價�。有關(guān)醫(yī)用鈦合金器械的
生物學(xué)評價標(biāo)準(zhǔn)總結(jié)于表5[112]。
4.2.2 醫(yī)用鈦合金材料的生物學(xué)性能及生物相容性研究
生物相容性(biocompatibility)是指材料與生物體之間相互作用后產(chǎn)生的各種生物�����、物理�、化學(xué)等反應(yīng)
或耐受能力,即材料植入人體后與人體的相容程度�,借此研究生物材料是否會對人體組織造成毒害作用。對
于與人體組織接觸或修復(fù)�����、替代病變組織的天然和合成的生物材料,或是外科植入物�、微創(chuàng)介入器件和有源
醫(yī)療器械,由于它們間接或直接與人體的組織和血液進行短期或長期接觸直至失效為止���,因此��,生物醫(yī)用材
料質(zhì)量的優(yōu)劣直接關(guān)系到患者的生活質(zhì)量和生命安危���,在其進入臨床應(yīng)用前必須確保其生物相容性和安全性
。
Okazaki等[113]的研究揭示了純金屬的細胞毒性����、外科植入材料的極化電阻和生物相容性的關(guān)系����,成為
合金元素選擇的重要參考依據(jù),并且認為Al����、V和Fe這3種元素是高度細胞毒性元素。大量臨床研究已經(jīng)證實
:TC4 鈦合金中的 V 因化學(xué)性質(zhì)不穩(wěn)定易引起生物學(xué)上的炎性反應(yīng)和纖維包囊����,其生物毒性要超過Ni和Cr
[114]��,而Al被證實會引起骨軟化�����、貧血和神經(jīng)紊亂等癥狀[115]�。根據(jù)純金屬及其合金的生物相容性測試可
以發(fā)現(xiàn)��,V����、Cd、Co�����、Hg����、Cr、Ni 等元素對細胞的接觸毒性較強��,Al、Fe元素次之[113,116,117]����。具
有磁性的Fe、Co�����、Ni等元素還會對射線造成阻礙���,不利于患者術(shù)后進行 CT 或 MRI 檢查��。因此��,優(yōu)先采用
Ti�、Zr�、Mo、Sn�����、Ta�、Nb����、Pd�����、Hf 等對于機體有益或毒副作用較小的合金添加元素��,將有利于提高或改善
鈦合金材料的生物相容性[118]�。
有關(guān)醫(yī)用鈦合金材料在體內(nèi)的骨整合性能�����,人們普遍認為是通過植體材料表面與周圍組織在分子及細胞
水平上的相互作用而完成的�����。鑒于細胞和蛋白質(zhì)尺寸分別是 1~100 mm 和 1~10 nm[119]��,因此����,生物材料
表面組織(結(jié)構(gòu))形態(tài)就對細胞黏附、生長和分化等產(chǎn)生重要影響��。當(dāng)鈦合金植入骨組織后很快就吸附周圍血
液�����、組織液中的生物大分子,如纖維粘連蛋白����、骨粘連蛋白、纖維蛋白原以及各種細胞因子(如骨形成蛋白
�����、b-轉(zhuǎn)化生長因子等)�����,然后形成生物大分子層并引起一系列的細胞學(xué)變化:細胞轉(zhuǎn)化因子引導(dǎo)未分化間充
質(zhì)細胞����、骨母細胞、成骨細胞向植體材料表面移行����,通過細胞粘連因子而發(fā)生貼壁,然后在細胞生長因子的
作用下出現(xiàn)增殖或分化等不同生物學(xué)反應(yīng)��,隨后在植體材料表面產(chǎn)生細胞層增殖��、分化�、合成并分泌細胞外
基質(zhì)而后礦化成骨。而植體材料表面的理化性質(zhì)也會影響生物大分子層的結(jié)構(gòu)���、組成和空間構(gòu)象�,進而導(dǎo)致
不同的細胞學(xué)表現(xiàn)���。
例如��,材料表面超細晶化后具有較高強度����、表面硬度和耐磨性等特性[120]����,同時材料表面組織(結(jié)構(gòu))
形態(tài)與其表面殘余應(yīng)力、表面能�����、表面電荷等也高度相關(guān)[121]���,而研究已證實成骨細胞對微納米尺度表面
粗糙度變化的響應(yīng)比傳統(tǒng)光滑表面更敏感[122]�����,且多孔結(jié)構(gòu)對于細胞分化功能的影響在一定范圍內(nèi)甚至可
以大于材料成分對于細胞分化功能的影響�����??梢姡侵踩氩牧媳砻孢x擇性吸附生物大分子是影響整個界面骨
愈合中間過程的控制環(huán)節(jié)并可通過細胞學(xué)的不同反應(yīng)表現(xiàn)出來�,成骨細胞在生物材料表面的貼壁率、生長曲
線���、細胞層堿性磷酸酶活性和蛋白質(zhì)含量等生物學(xué)指標(biāo)均可反應(yīng)細胞的生長與功能分化特性���,而從組織愈合
的一般性到骨愈合的特殊性均可較全面地反映骨科材料促進界面骨性愈合的能力,因而可作為研究和評價鈦
合金材料生物相容性的重要內(nèi)容和評價指標(biāo)[123]���。
4.3 醫(yī)用鈦合金材料的生物力學(xué)及其相容性研究
目前人工牙種植體��、關(guān)節(jié)等假體使用到一定時間時都會發(fā)生松動��,最常發(fā)生的松動為術(shù)后晚期松動��,或
稱“無菌性松動”�、“機械性松動”。術(shù)后晚期松動是一個漸進過程�,隨著骨與假體間機械連接完整性逐漸
遭到破壞�����,在兩者之間會形成一層纖維結(jié)締組織����,它隨時間慢慢增厚并最終導(dǎo)致假體松動[106]。長期臨床
應(yīng)用研究已經(jīng)證實�����,早期純Ti牙種植體術(shù)
后 5~9 a 的隨訪發(fā)現(xiàn)�����,位于上���、下頜骨的種植牙松動率分別是 19%和 9%[105]���。Ti6Al4V 鈦合金牙種植體
植入病人口腔6個月后因生物力學(xué)設(shè)計不當(dāng)出現(xiàn)了植體提前折斷現(xiàn)象
[124,125]。盡管目前牙種植體的手術(shù)成功率已普遍超過 95%���,但對 10 a 植入的患者跟蹤研究顯示�,鈦牙
種植體由于假體失效帶來的翻修手術(shù)仍維持在 5%左右[126]。Ti 人工髖關(guān)節(jié)也存在類似問題:術(shù)后8~10 a
�����,約90%的關(guān)節(jié)假體都需要二次手術(shù)翻修�,與自然骨的生物力學(xué)設(shè)計不佳導(dǎo)致的假體松動、下沉或折斷也是
其主要原因并占所有翻修手術(shù)的80%[119]����。
生物力學(xué)(biomechanics)是從生物體、器官����、組織到細胞乃至分子等不同層次研究生命中應(yīng)力與運動、
變形���、流動乃至生長關(guān)系的重要學(xué)科�����。人體始終處于力學(xué)環(huán)境之中且大多數(shù)組織都含有力學(xué)敏感細胞��,如成
骨和軟骨細胞等�����,許多重要臨床現(xiàn)象和應(yīng)用與生物力學(xué)直接相關(guān)����,例如牽張成骨���、骨修復(fù)與重建��、不同應(yīng)力
環(huán)境與組織再生的關(guān)系等���。骨科生物
力學(xué)已經(jīng)成為當(dāng)今生物醫(yī)學(xué)工程領(lǐng)域一門基礎(chǔ)科學(xué)和工程學(xué)科。而生物力學(xué)相容性(biomechanical
compatibility)是指植入材料要有足夠的強度�,能夠?qū)⑤d荷均勻、連續(xù)���、持久地傳遞到體內(nèi)待治療骨�����、齒硬
組織上�����,并使施體與受體之間在結(jié)合界面處發(fā)生較好地匹配���、共存和相互協(xié)調(diào)的能力[111]���。當(dāng)植入材料超
過彈性允許應(yīng)變而發(fā)生塑性變形時,即意味著植入材料隨后會產(chǎn)生失效����。判定植入材料和周圍骨組織彈性形
變是否匹配,必須考慮材料強度(硬度)���、剛度(彈性模量)�����、疲勞性能(疲勞極限)���、超彈性(應(yīng)力-應(yīng)變行為)
等諸多力學(xué)性能因素。而彈性模量 E 是材料在彈性變形階段應(yīng)力 s 和應(yīng)變 e 的比值(即E=s/e)���,代表材料
的剛度指標(biāo)���,它反映了材料內(nèi)部原子��、離子或分子間的結(jié)合力����,通常是恒定值�,與材料強度呈正相關(guān)。彈性
允許應(yīng)變(Rp/E����,其中Rp為材料的屈服強度)是反映材料在不發(fā)生塑性變形前所能承受的可恢復(fù)原有彈性變形
的能力���。據(jù)臨床專家統(tǒng)計測算����,每年正常成年人用于一日三餐等咀嚼運動平均約 100 萬次
(106)����,這與人體一側(cè)髖關(guān)節(jié)每年運動周期數(shù)相當(dāng)[127],特別是在一個正常的步態(tài)周期內(nèi)��,人
的髖��、膝和踝關(guān)節(jié)會承受高達3~10倍于體重的載荷,從而可導(dǎo)致骨骼局部產(chǎn)生非常高的應(yīng)力[106]��,而且疲
勞破壞還可以在應(yīng)力低于彈性極限時發(fā)生�。據(jù)權(quán)威資料報道[106],健康成年人皮質(zhì)骨所承受的最大彈性應(yīng)
變約為1%左右�,而松質(zhì)骨所承受的最大彈性應(yīng)變可達 4%。健康成年人的皮質(zhì)骨力學(xué)性能隨著年齡的增長而
緩慢降低�,從20歲到90歲,皮質(zhì)骨的抗拉強度和彈性模量每10 a減小2%��。這就對金屬植入材料在長期動態(tài)服
役條件下的強度�、剛度、彈性允許應(yīng)變和疲勞力學(xué)性能提出了更高的生物力學(xué)相容性的設(shè)計要求�。
科研人員通過對純 Ti 和 TC4 鈦合金牙種植體失效斷裂機制分析證實[128],具有高 E 值的鈦牙種植
體植入 10~15 a 后部分植體出現(xiàn)松動�、脫落、斷裂等情況�����,這與人咀嚼時受到反復(fù)載荷作用而產(chǎn)生應(yīng)力遮
擋和疲勞損傷密切相關(guān)��。在長期循環(huán)應(yīng)力作用下����,鈦合金材料也會出現(xiàn) E 值降低而發(fā)生剛性軟化的現(xiàn)象
[129]�。Niinomi 等[34]則研究了一種 E 值可調(diào)控的β型鈦合金�,即在反復(fù)彎曲變形時,由于原始b基體上
析
出大量非平衡中間過渡相w相組織而使合金彈性模量不降反增����。如果植入材料的E值低于骨組織,植入體過大
的形變將超過周圍骨組織自身的應(yīng)變或彈性允許范圍����,長期服役下將會造成兩者發(fā)生相對移動并使植入體產(chǎn)
生疲勞損傷并最終失效。另外�,骨的生理成長環(huán)境也要求Ti植體的彈性允許應(yīng)
變應(yīng)與其相匹配,如人體皮質(zhì)骨的Rp/E為0.67%�,它與純 Ti (0.66%)的接近,而 TC4 合金 Rp/E 值較高
(0.85%)[130]��,這顯然不利于植入體保持長期的生物力學(xué)穩(wěn)定性��。
近年來���,有限元分析方法成為外科植入物的生物力學(xué)研究、評價和指導(dǎo)其產(chǎn)品設(shè)計開發(fā)的有效輔助手段
��。目前多數(shù)研究者[131]普遍證實:植體材料本身過高的彈性模量可導(dǎo)致鈦牙種植體根部尖端處的應(yīng)力過于
集中而其頸部出現(xiàn)“應(yīng)力遮擋”或“應(yīng)力屏蔽”現(xiàn)象(植入體材料與骨組織兩者之間應(yīng)力傳導(dǎo)和分布與原有
骨組織生理功能不吻合)�,而降低材料本
身的E則有利于將種植體所承受的載荷以壓應(yīng)力等形式傳遞到周圍骨組織中去,從而可使得種植體與骨組織
之間的結(jié)合強度增高,促使種植體四周形成的新骨厚度增加[106]��。例如�,Shibata 等[132]采用有限元模擬
研究發(fā)現(xiàn),鈦合金假體(低 E 值)遠端的骨應(yīng)力比鈷合金(高 E 值)低 30%�����,造成假體遠端比近端的骨質(zhì)疏松
嚴重���;在皮質(zhì)骨區(qū)域����,鈦合金微孔假體柄部骨質(zhì)長入量高于鈷合金 20%~30%�����。對于目前市場上主流的非骨水
泥型(生物型)髖關(guān)節(jié)柄近骨端采用多孔化或涂層等處理(降低 E)�����,其設(shè)計理念���,一是為了將所承受的應(yīng)力傳
導(dǎo)至近骨端而非遠端骨組織���,從而有利于減少應(yīng)力遮擋和適應(yīng)性骨吸收�;二也有利于以后可能的翻修手術(shù)
[106]��。但是�,研究者們利用有限元數(shù)值模擬計算得到的最佳彈性模量區(qū)間為10~70 GPa[133]。
本文作者所在課題組[134]研發(fā)的新型介穩(wěn)定β型TLM 鈦合金���,該材料在加工和熱處理過程中�,通過“
馬
氏體轉(zhuǎn)變”和中間過渡相“w 相”等顯微組織調(diào)控���,可獲得高強度���、低模量及其它綜合生物力學(xué)性能匹配。
例如�,當(dāng)合金彈性模量為 50 GPa 時���,其抗拉強度約為 600 MPa�、彈性允許應(yīng)變?yōu)?0.62%�����,而延伸率可達到
40%以上,較純Ti具有明顯的優(yōu)勢����;當(dāng)抗拉強度達到 1000 MPa 時,其彈性模量約 90 GPa���,而此時材料延伸
率仍可達到 15%�,這是目前常用的醫(yī)用 TC4 (TC4 ELI)合金所遠不及的�。因而TLM鈦合金在靜態(tài)條件下展現(xiàn)
出良好的生物力學(xué)相容性。而 TLM 鈦合金材料經(jīng)循環(huán)加載和疲勞實驗后仍具有較高的疲勞強度極限
(sN≥500 MPa����,循環(huán)次數(shù)為107 cyc)和可恢復(fù)應(yīng)變(emax-R≤2.25%),因此TLM鈦合金有望在長期動態(tài)負載條
件下繼續(xù)保持原有自身優(yōu)良的生物力學(xué)相容性[135]�����。
4.4 醫(yī)用鈦合金材料的表面改性及功能化研究
4.4.1 醫(yī)用鈦合金材料的表面改性技術(shù)概述
提高鈦合金表面的生物活性�、耐磨性、抗凝血性等功能特性并以此改善鈦合金的生物相容性��,已成為近
年來科技工作者努力的發(fā)展方向��。例如��,采用各種物理和化學(xué)方法在醫(yī)用鈦合金表面制備一層與鈦合金基體
結(jié)合良好的活性陶瓷涂層或 TiO 及其復(fù)合涂層、嫁接大分子等���,進而研究涂層與細胞生物化學(xué)反應(yīng)����,植入
物與組織的相互作用�����。目前熱點研究的生
物活性陶瓷涂層體系主要包括羥基磷灰石(HA)[136]��、氟磷灰石(FA)[137]�、生物玻璃[138]等,而陽極氧化
法���、微弧氧化法��、等離子噴涂��、溶膠凝膠法���、磁控濺射法、離子束動態(tài)混合法����、激發(fā)物激光沉積法等技術(shù)仍
是當(dāng)前研究者普遍常用的主要方法。
鈦合金作為心臟瓣膜����、血管支架等與人體血液接觸器械產(chǎn)品的主要原材料,大量的實驗證明裸支架植入
血管后會誘導(dǎo)內(nèi)皮細胞生長因子的激活從而導(dǎo)致內(nèi)皮細胞增殖�、遷移,并進而誘發(fā)平滑肌細胞增生����,最終引
發(fā)血栓形成而導(dǎo)致支架再狹窄。離子注入法等表面改性方法可有效提高醫(yī)用鈦合金表面的血液相容性��,通過
表面修飾使支架具有更好的血液相容性[139]����。
人工關(guān)節(jié)材料要求具備足夠的耐磨性,否則因經(jīng)常的微動和磨損而提前引起假體松動失效���。針對醫(yī)用鈦
合金耐磨性相對較差問題���,目前有關(guān)鈦合金耐磨涂層制備方法主要包括熱噴涂、電鍍與化學(xué)鍍���、物理和氣相
沉積�、離子注入、磁控濺射���、微弧氧化法以及表面復(fù)合處理等技術(shù)�,常用的耐磨表面涂層有類金剛石膜�、
TiN 涂層等。其中離子注入技術(shù)不僅可以改善鈦合金的表面硬度��、降低材料表面摩擦系數(shù)�,還可以進一步將
表面功能改性,比如在 Ti 表面注入Ca2+�����,能夠加速在材料表面形成Ca3(PO4)2���,促進成骨細胞在材料表面
的黏附生長��,更有利于形成新的骨組織[140,141]�����。而在 Ti-Ni 合金中等離子浸沒離子注入 N�����,能顯著減少
Ni+的釋放���,在不影響其記憶功能的前提下降低生物毒性[142]。
針對鈦合金表面微納米化后其表面納米結(jié)構(gòu)有利于體內(nèi)細胞的黏附�����、分化和增殖的特點�,研究者們研究
和開發(fā)出了3種可實現(xiàn)金屬材料表面微納米化的常用方法:(1) 表面涂層:將具有納米尺度的顆粒固結(jié)在材
料表面,形成一個與基體化學(xué)成分相同(或不同)的納米結(jié)構(gòu)表層���,其主要特征是納米層的晶粒大小較均勻���,
表層與基體之間存在明顯界面,通過工藝參數(shù)可以調(diào)控納米層的厚度和晶粒尺寸�,但材料外形尺寸與處理前相比略有增加。該技術(shù)的關(guān)鍵是如
何實現(xiàn)表層與基體以及表層納米顆粒之間的牢固結(jié)合�,并保證表層不發(fā)生晶粒長大;(2) 表面自身微納米化
:對于多晶材料采用非平衡處理方法可增加材料表面粗糙度和自由能�����,使原始粗晶組織逐漸細化至微納米量
級,其主要特征是晶粒尺寸沿厚度方向逐漸增大��,納米層與基體之間不存在界面����,材料與處理前相比其外形
尺寸變化不大。目前表面機械加工處理和非平衡熱力學(xué)法是采用非平衡過程實現(xiàn)表面微納米化的2種主要方
法����;(3) 混合方式:將表面納米化技術(shù)與化學(xué)處理有機結(jié)合,即在材料的納米結(jié)構(gòu)表層形成與基體成分不同
的微納米晶固溶體或化合物�,該方法因綜合了上述方法的優(yōu)點而更顯實用化。
目前醫(yī)用鈦合金的表面納米化研究多數(shù)集中在由表面機械加工處理導(dǎo)致的表面自身納米化�����。
主要方法包括機械研磨��、超聲噴丸�����、高速沖擊等��。而表面機械研磨處理方法(SMAT)是近年來新興的一種
表面納米化技術(shù),其操作簡單����,在表面納米晶與基體組織之間不發(fā)生剝層和分離,應(yīng)用潛力巨大�����,可為研究
強烈塑性變形導(dǎo)致的晶粒細化及其力學(xué)行為提供理想條件[143]��。金屬材料表面微納米化后賦予其新的表面
結(jié)構(gòu)和狀態(tài)�����,它不僅保持甚至提高了材料自身的力學(xué)性能�����,而且使其具有了納米生物學(xué)的優(yōu)點��。
4.4.2 醫(yī)用鈦合金材料的表面改性及其功能化研究
鑒于天然骨主要由具有微納米結(jié)構(gòu)的 HA組成�,對于骨科和齒科材料而言����,設(shè)計和獲取材料具有微納米
尺度的粗糙度表面顯然很有必要�。研究[144]發(fā)現(xiàn)�����,具有納米拓撲結(jié)構(gòu)的粗糙表面對成骨細胞的增殖和分化
較平滑表面敏感度增強����,且材料比表面積及表面能隨著其表面粗糙度增加而提高,這促使成骨細胞的黏附�����、
增殖�、堿性磷酸酶活性以及含鈣礦物質(zhì)沉積能力相應(yīng)提高。因此��,表面微納米化有利于提高鈦合金表面活性
�,改善其生物相容性。
鈦合金表面氧化膜帶負電荷可抑制血栓形成��,提高了其血液相容性�����。而鈦合金中 Zr��、Nb、Ta 等元素易
形成 ZrO2����、Nb2O3、Ta3O5等硬質(zhì)表面氧化膜�����,其致密表面可抑制金屬離子溶出��、提高耐蝕性�,而其表面硬
度提高也加強了原表面 TiO2層保護性,提高了耐磨性����。已有研究表明�����,超細晶或納米晶化處理后的鈦合金
的彈性模量降低���,與皮質(zhì)骨彈性模量更接近���;而且其硬度也有一定增強�,減少了骨關(guān)節(jié)面磨屑的產(chǎn)生����,從而
提高了鈦合金的生物力學(xué)相容性。因此將表面微納米化技術(shù)應(yīng)用到人工關(guān)節(jié)�����、牙種植體與骨關(guān)節(jié)摩擦磨損接
觸的界面�����,將有助于延緩假體松動的發(fā)生�����。Hélary等[145]���、Hoshikawa等[146]��、Pegg等[147]��、Zhang等
[148]����、Neoh等[149]分別將苯乙烯磺酸鈉、甲基硅氧烷�����、醋酸乙烯酯�����、絲�����、殼聚糖�、葡聚糖、RGD 肽等引入
鈦合金表面��,該功能化表面大大提高了涂層的生物活性����。Rychly等[150]利用在植入材料與細胞之間基體透
明質(zhì)酸帶負電的特性���,在鈦合金表面嫁接功能化氨基����,引導(dǎo)成骨細胞,進而引導(dǎo)骨形成�。而采用細胞學(xué)和分
子生物學(xué)方法將蛋白質(zhì)、細胞生長因子���、酶等固定在支架表面�����,可有效提高鈦合金的血液相容性��,減少并發(fā)癥���,引導(dǎo)內(nèi)皮細胞快速準(zhǔn)確定向生長,加快植入物內(nèi)皮化速度���。將具有生物活性的分子固定在血
管內(nèi)支架�����,可以明顯地降低纖維蛋白原的吸附�����、沉積以及血小板的活化�,顯現(xiàn)出極好的生物相容性。Huang
等[151]通過表面機械磨損處理(SMAT)在新型TLM合金上制備出納米和超細晶粒的b-Ti層�,且納米晶層表面的
成骨細胞黏附、增殖���、成熟和礦化的顯著增強����。本文作者所在課題組采用將納米管預(yù)涂層制備�����、載銀處理與
微弧氧化技術(shù)相結(jié)合以及一步電化學(xué)法在 TLM 合金上制備出 2 種活性抗菌涂層���,涂層表面 Ag 元素質(zhì)量分
數(shù)分別達到 3.1%和3.6%��,平板涂布法測試發(fā)現(xiàn)2種抗菌涂層在1 d后對金黃色葡萄球菌的抑菌率分別達到
99.1%和98.7%�����,且在 4 d 后對金黃色葡萄球菌的抑菌率仍保持在90.2%和 86.3%,與同期無 Ag 對照樣相比
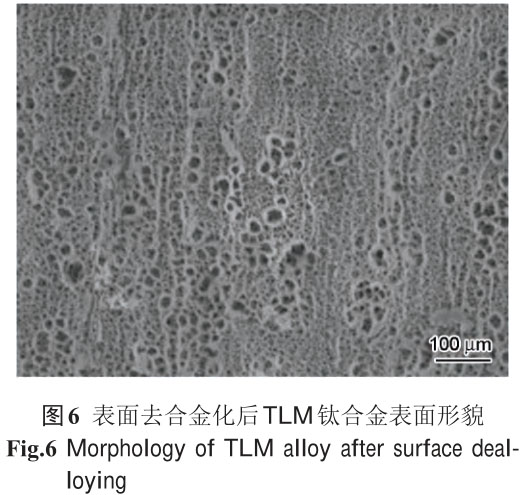
抗菌效果顯著��。該研發(fā)團隊還采用去合金化法在 TLM 鈦合金表面制備出了具有納米尺度的微孔層�,該納米
微孔層沒有引入復(fù)雜的���、較脆弱的陶瓷或高分子涂層,不存在結(jié)合強度差的臨床應(yīng)用難題����;并且人體組織直
接與植入物結(jié)合而不存在額外界面,不僅沒有涂層脫落的風(fēng)險����,而且組織/骨結(jié)合率與結(jié)合強度高,可實現(xiàn)
快速骨整合與壓力承載�。細胞實驗結(jié)果表明,去合金化TLM鈦合金具有更高的親水性和細胞黏附率�����,黏附細
胞活性也高于未處理 TLM 鈦合金��。
有關(guān)表面去合金化后 TLM 鈦合金表面形貌如圖 6所示�。
近年來,隨著材料科學(xué)��、生命科學(xué)�、臨床醫(yī)學(xué)及物理、化學(xué)、影像學(xué)等學(xué)科交叉發(fā)展和技術(shù)進步�,具備
細胞/基因活化和誘導(dǎo)功能的智能化生物材料是臨床治療發(fā)展的必然要求和趨勢,它們可從分子水平刺激細
胞的增殖和分化���,引發(fā)特異性細胞反應(yīng)�����,抑制非特異性反應(yīng)�����,逐漸實現(xiàn)黏附��、分化����、增殖��、凋亡及細胞外基
質(zhì)(ECMs)的重建��,進而促進組織的再生與修復(fù)[152]����。賦予生物材料上述“生物功能化”��,單憑冶金和加工過程無法實現(xiàn),必須借助材料
表面改性或修飾來改變其表面理化性質(zhì)�����。表面修飾旨在介導(dǎo)材料表面與細胞的相互作用���,如何控制生物材料
的生物響應(yīng)����,抑制其非特異性響應(yīng)�����,是生物材料表面修飾的出發(fā)點[153,154]����,而理想的表面修飾涉及表面
元素特征、微觀拓撲結(jié)構(gòu)��、親水-疏水平衡��、蛋白質(zhì)吸附等各個方面[155,156]�����。基于細胞膜的兩親性雙分子
層結(jié)構(gòu)及細胞膜的“流動鑲嵌”模型��,具有仿細胞膜結(jié)構(gòu)的層層自組裝技術(shù)并在生物材料表面工程和基因釋
放研究領(lǐng)域的應(yīng)用正引起人們的廣泛關(guān)注��,為發(fā)展新的基因釋放策略和開發(fā)基因活化生物材料提供了新的思
路�。材料表面的分子自組裝不僅具有較大的流動性和可變形性,賦予細胞適宜的自組裝生長材料表面拓撲結(jié)
構(gòu)��,還能改善材料的生物相容性和降低非特異性作用���。大量實驗已證明材料表面的化學(xué)成分��、組織(結(jié)構(gòu))形
態(tài)���、微觀力學(xué)特性、表面能等都可轉(zhuǎn)導(dǎo)為生物信號并在分子水平上有效地和特異性地調(diào)節(jié)人體附著細胞功能
性基因的表達�、信息核糖核酸的結(jié)構(gòu)穩(wěn)定、基因產(chǎn)物的合成等[157~159]�,從而有效地產(chǎn)生“材料的誘導(dǎo)性
生物功能效應(yīng)”,它不僅決定了生物材料的安全性�、功能性、適配性�,也決定了其對于重建人體機體組織和
生理功能的調(diào)控性�。
4.5 醫(yī)用鈦合金材料的增材制造
鈦合金材料表面經(jīng)過多孔化處理后可為骨科器械提供所需要的合適三維微孔結(jié)構(gòu)及適宜的臨床生物力學(xué)
性能要求���,但大規(guī)模批量生產(chǎn)的外科植入物通常很難完全使其與周邊骨組織精確緊密配合或高度吻合病灶的
外部輪廓���。由于人體骨骼的差異性���、缺損部位形態(tài)的隨機性��,使得標(biāo)準(zhǔn)化的植入體常常不能滿足臨床使用要
求�����。最好的人工假體應(yīng)該是個性化產(chǎn)品��,可滿足患者個性化治療的需求����。增材制造技術(shù)(3D 打印)可使金屬
植入物的三維個性化設(shè)計����、孔隙結(jié)構(gòu)定制和快速凈成型完美地結(jié)合在一起,這在所有的傳統(tǒng)工藝中是不能想
象的����,并已成為高端個性化醫(yī)療器械設(shè)計��、制造和應(yīng)用推廣的重點發(fā)展方向和未來發(fā)展趨勢��。
4.5.1 金屬粉末的應(yīng)用技術(shù)要求
鈦合金金屬粉末一直是軍工及民用各領(lǐng)域中用于粉末冶金產(chǎn)品生產(chǎn)的關(guān)鍵材料��。與其它粉末冶金技術(shù)相
比���,3D打印技術(shù)對于Ti粉的要求較高,除需具備良好的可塑性外����,還必須滿足粉末粒徑細小、粒度分布較窄
���、球形度高��、流動性好和松裝密度高等要求���。目前金屬 3D 打印常用的鈦合金粉末按粒度范圍可分為細粉
(15~53 mm)、半粗粉(53~105 mm)�����、粗粉(105~150 mm),它是根據(jù)配置不同能量源的金屬打印機工作特點而
劃分的:對于激光打印機�,因其聚焦光斑精細,粉末補給方式為逐層鋪粉�,采用細粉作耗材比較適合;對于
電子束或等離子束打印機�����,聚焦光斑略粗��,粉末補給方式為同軸送粉�����,選用相對低廉的半粗粉或粗粉即可�����。
目前��,氣霧化法�、等離子旋轉(zhuǎn)電極法已成為生產(chǎn) 3D 打印金屬粉末的主流制備技術(shù)����。鈦合金粉末的粒度
��、粒度分布和顆粒形狀與生產(chǎn)金屬粉末的方法和工藝密切相關(guān)�。一般由金屬氣態(tài)或熔融液態(tài)轉(zhuǎn)變成粉末時�����,
粉末顆粒形狀趨于球形�����;由固態(tài)轉(zhuǎn)變?yōu)榉勰r�����,粉末顆粒趨于不規(guī)則形狀��;而采用溶液電解法制備的粉末多
數(shù)呈樹枝狀�。采用氫化脫氫法所得粉末外形普遍呈現(xiàn)棱角或者鋸齒狀,從而在通過輸送軟管或者鋪在 3D 打
印床上時易出現(xiàn)彼此勾連����。
而球形精細金屬粉體具有更好的流動性,且完美的球形導(dǎo)致粉末能夠更緊密的堆積���,所生產(chǎn)的器械產(chǎn)品
無論是密度還是強度都比采用粗粉或無定形的質(zhì)量更好��。對于 3D 打印鈦合金金屬粉末而言��,氣體 O�����、N 雜
質(zhì)含量通?�?刂圃?1500×10-6以下����。因為打印過程中金屬重熔后,元素以液體形態(tài)存在���,易產(chǎn)
生元素的揮發(fā),且原始粉末中難免會摻雜衛(wèi)星球��、空心粉等微量次品��,因此不可避免地在定制產(chǎn)品局部生成
氣孔缺陷�,或者造成產(chǎn)品成分異于原始粉末或者母合金的成分,從而影響到產(chǎn)品的致密性及其力學(xué)性能�。
4.5.2 醫(yī)用鈦合金材料的增材制造應(yīng)用研究
相比于傳統(tǒng)的車、銑、刨�����、磨等減材技術(shù)��,鈦合金醫(yī)療器械加工若采用增材制造技術(shù)����,不僅可帶來更大
的設(shè)計及制造自由度,而且對于具有復(fù)雜結(jié)構(gòu)以及個性化產(chǎn)品的加工成本和效率上都體現(xiàn)出較傳統(tǒng)技術(shù)無可
比擬的優(yōu)勢[160]�。增材制造技術(shù)還很容易引入多孔互通結(jié)構(gòu)以增加植入物的生物相容性,促進骨融合�����,在
保證其生物力學(xué)行為的基礎(chǔ)上達到最大的減重效果[160~162]�����,并降低金屬結(jié)構(gòu)的硬度��,從而盡量達到與天
然骨匹配的力學(xué)性能��,減小應(yīng)力屏蔽效應(yīng)[163]�����。
特別是,3D 打印技術(shù)使得根據(jù)實際應(yīng)用環(huán)境���,在不同部位采取不同材料和結(jié)構(gòu)�����、或在特定區(qū)域設(shè)計特
定理化性能�,以達到設(shè)計需求的多功能的外科植入物成為現(xiàn)實����,而這是采用粉末燒結(jié)等傳統(tǒng)加工手段很難實
現(xiàn)的。
上世紀(jì) 90 年代國際上發(fā)展起來的激光立體成形(laser solid forming����,LSF)等快速成型技術(shù),目前已
成功制備出多孔純Ti��、TiNi和TC4合金材料�,并在人工關(guān)節(jié)臼杯上實現(xiàn)了多孔 CoCrMo/Ti6Al4V 功能梯度材
料[164]�����。3D打印技術(shù)還能將鈦合金、鈷合金等醫(yī)用金屬粉末制作成患者所需的三維多孔金屬植入物��,在梯
度孔徑�、孔隙、孔與孔之間完全實現(xiàn)三維貫通�,而且金屬假體的彈性模量完全可以由預(yù)先設(shè)計來確定[165]
。Heinl 等[166]采用選區(qū)電子束法����、Traini 等[167]采用激光直接成形法分別對多孔鈦合金的3D打印技術(shù)
進行了研究,而 Murr 等[168]研究了孔隙率����、孔型等對 3D 打印多孔鈦合金性能的影響。
Parthasarathy[169]通過電子束加工(EBM)技術(shù)制造互通多孔 Ti6Al4V����,通過控制孔隙率以及實體支架
的尺寸,達到不同力學(xué)性能����;孔隙率在 75%~55%之間的激光選區(qū)熔化(SLM)法加工 Ti 結(jié)構(gòu)件的壓縮強度在
35~120 MPa 之間,而孔隙率在 49.75%~70.32%的 EBM 法加工 Ti6Al4V 合金件的壓縮強度在 7~163 MPa之
間[170~174]�。
采用 3D 打印技術(shù)獲得的多孔金屬外科植入物在骨科器械應(yīng)用方面具有獨特優(yōu)勢:具有類骨小梁結(jié)構(gòu)的
金屬骨植入物有利于人體骨細胞在其中黏附生長并與骨骼之間形成堅強的絞鎖結(jié)合能力,可促進假體與骨界
面的骨性愈合���,從而延長假體的使用壽命[175~177]����。本文作者所在課題組通過CT掃描和轉(zhuǎn)換(mimics)及臨
床統(tǒng)計數(shù)據(jù)反饋,利用有限元分析研究了多孔結(jié)構(gòu)�����、鈦合金材料對預(yù)先設(shè)計的梯度多孔材料的力學(xué)性能的影
響��,并結(jié)合對數(shù)據(jù)和模型進行優(yōu)化再設(shè)計���,最后通過激光選區(qū)熔化制備出類骨小梁組織的多孔 TLM 鈦合金
植入物材料���,如圖 7 所示。

5�����、 總結(jié)與展望
雖然我國 Ti資源豐富��,鈦合金材料產(chǎn)能及產(chǎn)銷量躍居世界第一位��,但在醫(yī)用鈦合金材料研究����、開發(fā)、
應(yīng)用方面卻相對滯后�,無論在科研、設(shè)備���、技術(shù)�����、工藝和人才等方面都無法與歐��、美發(fā)達國家相比�����,導(dǎo)致此
類高端醫(yī)療器械及其加工用原材料嚴重依賴進口����,給我國廣大民眾的醫(yī)療保健水平提高和全民醫(yī)保國策的落
實帶來很大的壓力�����。近年來���,圍繞提高材料強韌性��、耐蝕性����、耐磨性、生物相容性���、力學(xué)相容性等為設(shè)計目標(biāo)的新型醫(yī)用鈦合金材料研究開發(fā)
日漸活躍�����,以改善其長效服役功能特性的生物活性涂層����、耐磨涂層�、抗凝血藥物涂層、抗菌涂層等為突出代
表的新型表面改性涂層及相關(guān)配套技術(shù)研究方興未艾�����,為新型鈦合金醫(yī)療器械的設(shè)計開發(fā)帶來了新的發(fā)展機
遇����,有望在未來的生物醫(yī)用材料的臨床應(yīng)用中繼續(xù)扮演著重要角色��。
5.1 醫(yī)用鈦合金原材料的提質(zhì)增效刻不容緩
目前國產(chǎn)醫(yī)用鈦合金原材料產(chǎn)品質(zhì)量及生產(chǎn)穩(wěn)定性等方面與國外水平差距較大,而高強低模量鈦合金等
新型醫(yī)用金屬材料尚未實現(xiàn)產(chǎn)業(yè)化和標(biāo)準(zhǔn)化�����,這需要對傳統(tǒng)量大面廣的醫(yī)用鈦合金材料進行優(yōu)化升級���,同時
積極開發(fā)國產(chǎn)質(zhì)優(yōu)價廉的新型的醫(yī)用鈦合金材料�����。
目前外科植入物用鈦合金材料的選材設(shè)計標(biāo)準(zhǔn)�,除了要求其生物安全性指標(biāo)合格外�,只考慮了材料的成
分、組織�、強度和塑性4個基本要求。隨著對其“生物力學(xué)相容性”以及與機體組織的“生物適配”���、“組
織適配”���、“力學(xué)適配”、“降解適配”等新興研究理念或概念的提出���,醫(yī)用鈦合金材料的設(shè)計標(biāo)準(zhǔn)要求也
隨之提高����,其中4個設(shè)計要素需要重點關(guān)注:(1) 確保合金的生物相容性,放棄或減少已證實對機體具有潛
在毒副作用的 Al�����、V 等合金元素���;(2) 力求合金的相組成(成分或結(jié)構(gòu))簡單化�,盡量避免金屬間化合物相
的形成�;(3) 提高合金的生物力學(xué)相容性,即除了降低其彈性模量以達到與人體骨組織的優(yōu)良匹配外���,還需
兼顧考慮合金的其它綜合力學(xué)性能如疲勞強度等��;(4) 降低合金的加工制造成本��,既要減少高熔點且昂貴的
Hf����、Ta 等合金元素含量,也要提高合金的易加工成型性��。因此�����,開展新型高強度低模量β鈦合金的設(shè)計研
發(fā)�,首先要考慮合金成分上的優(yōu)選和優(yōu)良綜合性能的預(yù)測�。其次,還要充分兼顧合金后續(xù)加工�����、熱處理過程
中的過程控制和實踐驗證���,最終才能實現(xiàn)醫(yī)用鈦合金材料的潔凈化�����、均質(zhì)化���、細晶化、多孔化�、低成本化等
終極目標(biāo)要求。
近年來,隨著新技術(shù)的不斷涌現(xiàn)及精密機械和電子工業(yè)的發(fā)展����,在有源醫(yī)療器械產(chǎn)品等尖端領(lǐng)域,產(chǎn)品
小型化��、微型化已然成為未來發(fā)展趨勢�����。然而�����,一般金屬材料的平均晶粒尺寸與微器件的特征尺寸相當(dāng)��,極
大地影響其尺寸精度和特殊功能的發(fā)揮����。
因此,高端醫(yī)療器械中應(yīng)用最多的超細晶化鈦合金材料受到了國內(nèi)外科學(xué)界的廣泛關(guān)注��。為了提高傳統(tǒng)
醫(yī)用純Ti的抗拉強度等力性指標(biāo)�����,國際上的設(shè)計理念是通過加工制備工藝創(chuàng)新來改變合金的晶粒尺寸至超細
晶或納米晶級別,以此來達到對傳統(tǒng)醫(yī)用鈦材的提質(zhì)增效��。早期研究認為���,納米純金屬的模量明顯低于相應(yīng)
的粗晶材料�����。但有研究[178]發(fā)現(xiàn)�����,低模量是樣品加工中殘留的缺陷造成的。按照常規(guī)力學(xué)性能與晶粒尺寸
關(guān)系(Hall-Petch 公式)推算����,納米材料應(yīng)該既具有高強度,又有較高韌性����,但很多納米金屬材料的強度、
韌性卻低于相應(yīng)粗晶材料�����。本課題組已經(jīng)發(fā)現(xiàn)[74],新型 TLM 鈦合金經(jīng)過仿 ARB 法加工至 16 層納米箔材
時其強度�����、韌性反而低于 8 層的微納米箔材��。采用 ECAP 法對工業(yè)純Ti 多次變形后其強度也發(fā)現(xiàn)存在一個
極限值�����。有關(guān)微納米晶粒尺寸����、形貌、界面狀態(tài)以及晶界等各類缺陷的性質(zhì)�、微觀應(yīng)力等多尺度效應(yīng)使得超
細晶化鈦合金材料力學(xué)性能的獨特變化規(guī)律和微觀塑性變形機理還不能用經(jīng)典理論逐一進行合理解釋。目前
國際上對多元醫(yī)用鈦合金超細晶塊材的開發(fā)應(yīng)用剛剛起步�����,尚有大量科學(xué)技術(shù)問題有待探討����,例如材料的制
備工藝、過程溫升及形變模擬分析�、組織演化機制和顯微組織�����、織構(gòu)分析表征�,以及相關(guān)物理��、力學(xué)性能研
究等��。
目前���,高孔隙率的多孔 Ti材料因具有類似于人體松質(zhì)骨的結(jié)構(gòu)���,有望在骨科修復(fù)器械領(lǐng)域獲得大量應(yīng)
用。但多孔鈦合金材料要滿足其長期臨床應(yīng)用��,其強度��、塑韌性和疲勞等力學(xué)性能也有待改進和提高�。目前
關(guān)于醫(yī)用鈦合金的 3D 打印產(chǎn)品主要集中于純 Ti 和 Ti6Al4V 合金�,其研究更多側(cè)重于標(biāo)準(zhǔn)形狀的精密成
型,即三維結(jié)構(gòu)多為簡單的立方�、六方等孔型結(jié)構(gòu)的有序疊加,對于國外臨床已廣泛應(yīng)用的���、含有較多高熔
點合金元素的第三代β鈦合金的3D 打印產(chǎn)品尚未見研究和應(yīng)用報道�����。實現(xiàn)高品質(zhì)多孔 Ti 商業(yè)化生產(chǎn)和應(yīng)
用還面臨許多技術(shù)難題需要攻關(guān)研究�,例如如何其實現(xiàn)孔徑、孔隙率和力學(xué)性能間的最佳匹配�����;多孔鈦合金
結(jié)構(gòu)(形狀���、尺寸���、均勻性等)與力學(xué)性能(模量、強度等)及生物學(xué)(骨組織長
入特性)的相互影響機制�����,多孔鈦合金低成本加工制造新方法探索����,以及多孔鈦合金力學(xué)性能的精確調(diào)
控及其加工過程、力學(xué)性能模擬和預(yù)報等����。
3D 打印產(chǎn)品的質(zhì)量和功效取決于優(yōu)質(zhì)的鈦合金多樣化的原材料��,不僅材料本身種類����、成分���、特性對3D
打印產(chǎn)品的性能有影響��,材料的制造工藝也對3D 打印產(chǎn)品的強度�、模量����、彈性等功能特性至關(guān)重要。我國
在等離子旋轉(zhuǎn)電極法�����、氣霧化法以及射頻等離子體球化法制備球形 Ti 粉的核心技術(shù)研究方面取得了長足進
步���,但與世界發(fā)達國家相比在高品質(zhì)球形Ti粉的生產(chǎn)技術(shù)、質(zhì)量控制和應(yīng)用等方面差距仍較大��,因而制約了
我國 3D 打印產(chǎn)品的快速發(fā)展。從國際范圍來看�����,隨著球形Ti粉應(yīng)用領(lǐng)域和需求量的不斷增加��,對金屬球形
Ti粉的生產(chǎn)技術(shù)和設(shè)備更新�����、產(chǎn)品精細化和低成本化要求將是大勢所趨�。因此,開展新型多元化β鈦合金
球形 Ti 粉制備技術(shù)研究�����,首先要加強粉體制備的基礎(chǔ)理論研究���,摸索此類特殊粉體的理化性能與工藝參數(shù)
之間的影響規(guī)律�,通過制粉工藝優(yōu)化和過程控制來實現(xiàn)球形Ti粉的高品質(zhì)��。同時�,針對人體骨組織的微孔無
序分布特點,還要重點研究短程無序的微孔仿生設(shè)計及其對生物力學(xué)性能的調(diào)控��。因此,加大對3D打印產(chǎn)品
及其鈦合金球形粉體原材料的研發(fā)和投入�����,走獨立自主的發(fā)展之路��,對我國搶占新一輪先進制造業(yè)發(fā)展制高
點意義重大���。
針對不同骨科�����、齒科和心血管介入用高端醫(yī)療器械產(chǎn)品的需求��,結(jié)合國內(nèi)外當(dāng)前的研究現(xiàn)狀�����,醫(yī)用鈦合
金材料設(shè)計開發(fā)和應(yīng)用的未來發(fā)展方向可總結(jié)如下:(1) 加強合金設(shè)計�、材料加工制備以及顯微組織和理化
性能之間相互作用規(guī)律和微觀影響機制的基礎(chǔ)研究����;(2) 大力開發(fā)先進的材料加工制造原理和方法的創(chuàng)新及
其應(yīng)用技術(shù)研究:(a) 單晶鈦合金,沿某一晶向生長可獲得非常接近人體骨的彈性模量���;(b) 超細晶鈦合金
材料的產(chǎn)業(yè)化技術(shù)和新應(yīng)用���;(c)具有超彈性和形狀記憶功能的醫(yī)用低模量鈦合金的組織和性能調(diào)控;(d)
多孔醫(yī)用鈦合金材料的先進制備技術(shù)更新和綜合性能優(yōu)化匹配���。(3) 開展醫(yī)療器械產(chǎn)品的優(yōu)化設(shè)計��,為新型
醫(yī)用鈦合金材料的開發(fā)和應(yīng)用提供理論指導(dǎo)���;(4) 加快醫(yī)用鈦合金原材料及相關(guān)產(chǎn)品的國家和行業(yè)標(biāo)準(zhǔn)化研
究和標(biāo)準(zhǔn)的制(修)訂。
5.2 醫(yī)用鈦合金材料的生物及力學(xué)相容性基礎(chǔ)和應(yīng)用研究亟待加強
自瑞典 Branemark提出骨整合理論以及德國醫(yī)生Andrea首次提出支架構(gòu)想以來����,提高鈦合金的生物和力
學(xué)相容性,有效解決醫(yī)用金屬假體與骨組織之間牢固結(jié)合�、持久耐用以及與血管等軟組織之間剛?cè)岵⒔?
低再狹窄率等科學(xué)難題成為世界各國研究的重點對象�����。醫(yī)用鈦合金材料的長期研發(fā)史和臨床應(yīng)用表明���,未來
醫(yī)用鈦合金材料的生物相容性和力學(xué)相容性基礎(chǔ)研究必須高度重視����,這是提高醫(yī)用鈦合金外科植入物在體內(nèi)
長期穩(wěn)定服役并發(fā)揮持久治療效果的關(guān)鍵,也是設(shè)計和開發(fā)新型醫(yī)用鈦合金材料的基礎(chǔ)和目標(biāo)�����。
研究生物材料與細胞間的生物相容性是設(shè)計和優(yōu)化醫(yī)用鈦合金的基礎(chǔ)和關(guān)鍵�����。細胞對生物材料的黏附���、
趨化及細胞在材料表面及內(nèi)部的生長�����、增殖��、分化和凋亡是一個復(fù)雜的過程�,且受到材料表面理化特性的影
響很大�����。骨髓基質(zhì)干細胞(BMSCs)移植或內(nèi)源性的 BMSCs 遷移黏附可以促進人工假體周圍骨整合,因此誘導(dǎo)
周圍組織中的BMSCs盡快向成
骨細胞分化是保證人工假體骨結(jié)合及體內(nèi)長期穩(wěn)定的關(guān)鍵[179,180]���。雖然材料表面微納米及多孔化等形態(tài)
可以影響干細胞向成骨的分化��,但鈦合金等骨植入材料的成分及表面組織(結(jié)構(gòu))形態(tài)(特別是納米尺度下)與
吸附蛋白、黏附細胞及細胞因子和生長因子之間的相互作用��,以及對影響骨整合的主要細胞來源-BMSCs的黏
附���、生長以及成骨分化調(diào)控的規(guī)律與分子機制和信號通路等研究仍需深化�����。而對植入材料與骨結(jié)合界面處的
成骨信號傳導(dǎo)通路的認知有利于在分子水平上指導(dǎo)生物材料的表面修飾�����,提高干細胞對材料早期感知與反應(yīng)
�����,并有望通過材料在設(shè)計上選擇性調(diào)控某些信息通路來促進骨植入材料的早期骨整合能力和長期穩(wěn)定性
[181]�。因此��,研究材料植入機體后對細胞功能的影響和變化(特別是材料學(xué)因素對于吸附蛋白、黏附細胞��、
引發(fā)細胞凋亡等)以及干細胞或骨前體細胞沿成骨方向分化的調(diào)控作用對于提高鈦合金的生物相容性�、發(fā)展
新的表面改性技術(shù)、闡明鈦合金的骨誘導(dǎo)作用機理具有重要意義���,并對進一步研究開發(fā)組織誘導(dǎo)性醫(yī)用鈦合
金新材料可提供有益借鑒��。
近年來���,隨著Ti等金屬植入材料品質(zhì)的不斷提高和醫(yī)學(xué)評價手段的日臻豐富,對植入材料生物安全性研
究和評價已不再是唯一判據(jù)�����。國際生物醫(yī)學(xué)工程學(xué)會以及國際生物材料標(biāo)準(zhǔn)化組織對外科植入材料的質(zhì)量標(biāo)
準(zhǔn)要求已從“可接受”的一般層次提高到“安全可靠”的更高層次���,這就迫使人們開始更多地關(guān)注植入體與
周圍骨組織的良性結(jié)合和功能性服役的長效性問題�����。因為在人體生理環(huán)境中�����,除了生物相容性好這一基本要
求外�����,還特別要求醫(yī)用金屬材料具有:(1) 生物功能性�����;(2) 長期穩(wěn)定性����;(3) 與骨組織之間有較好的生物
力學(xué)適配性����。因此,鈦合金材料的長效生物安全性和生物力學(xué)的應(yīng)用研究及評價已成為設(shè)計開發(fā)新型高性能
醫(yī)療器械產(chǎn)品并擴大其臨床應(yīng)用的關(guān)鍵所在��,而生物力學(xué)相容性研究和評價應(yīng)該成為設(shè)計開發(fā)新型外科植入
金屬材料及其器械的理論基礎(chǔ)和研究重點��。
5.3 醫(yī)用鈦合金材料的表面功能改性是提高外科植
入物使役性能的關(guān)鍵所在在生理環(huán)境中����,植入材料與機體組織之間的相互作用總是發(fā)生在材料表面。材
料表面的物理化學(xué)特性必然直接影響到組織的愈合��。同時,機體環(huán)境也可作用于材料表面����,并使之發(fā)生腐蝕
、降解及變性�。植入材料的生物相容性和生物活性與表面理化特性密切相關(guān)。因此���,控制和改善生物材料的
表面特性是提高植入材料生物相容性和生物活性的有效途徑�。由于醫(yī)用鈦合金的結(jié)構(gòu)和性質(zhì)與自然骨相差很
大�����,并且其成分與人體機體組織的成分截然不同���,植入體內(nèi)后難以與硬組織形成生物化學(xué)結(jié)合或與軟組織快
速融合等�����,加之其表面鈍態(tài)氧化膜的存在��,通常不利于與骨組織發(fā)生化學(xué)鍵性結(jié)合���,而易被纖維性膜所包圍
并造成與周圍的骨組織隔離��,從而可造成外科植入治療的失敗�����。開展醫(yī)用鈦合金表面改性以提高其生物活性
等功能特性始終是生物醫(yī)學(xué)工程的一個研究熱點和重點研究方向�,也是生物材料學(xué)科最活躍和發(fā)展迅速的領(lǐng)
域之一���。
已經(jīng)證實���,人工金屬假體的結(jié)構(gòu)設(shè)計和表面狀態(tài)是影響其長期植入穩(wěn)定性或長效性的重要因素。因此�,
外科植入技術(shù)在過去半個世紀(jì)發(fā)展中��,圍繞骨整合這一基本理論(由于金屬植入體自身屬“惰性材料”���,其
與周圍骨組織的結(jié)合不是骨性結(jié)合)科研工作者已開展了大量的相關(guān)研究工作��,并對改善鈦合金植入物早期
骨組織生長���、降低假體松動具有一定的臨床應(yīng)用價值:許多學(xué)者先后提出了“物理性結(jié)合”、“化學(xué)性結(jié)合
”及“生物性結(jié)合”等概念��,其主要目的都是為了改善外科植入材料表面的“生物活性”以充分實現(xiàn)植入體
的早期修復(fù)功能。如前所述�,從宏觀角度出發(fā),對 Ti 植入體進行表面改性處理�,如機械拋光、酸蝕處理�、
梯度多孔化、活性涂層制備等技術(shù)來實現(xiàn)材料表面粗糙化和功能化���;從微觀角度出發(fā)�����,利用生物技術(shù)方法引
入活性大分子或骨生長因子等�,使其對破損骨組織的修復(fù)����、功能調(diào)控及重建發(fā)揮重要作用;從改善Ti植入物
自身生物力學(xué)功能性方面出發(fā)��,對鈦牙種植體結(jié)構(gòu)����、長度、直徑等重要參數(shù)進行設(shè)計優(yōu)化,以及嘗試改變種
植體與上部基臺的連接方式等���;從患者自身條件出發(fā)�����,改善植入體的抗菌性或采取即刻種植技術(shù)等����。具有超
細晶表面結(jié)構(gòu)的鈦合金有望成為一種生物和力學(xué)相容性俱佳的新型外科植入材料�����,這是因為經(jīng)大塑性累積變
形或表面微納化處理的超細晶鈦合金材料����,其表面結(jié)構(gòu)與理化狀態(tài)諸如表面形貌(粗糙度)、尺度大小(晶粒
尺寸���、粒子邊界、比表面積)���、親疏水性����、荷電性(自由電子、比表面能)以及表面硬度����、耐磨和耐蝕性等與
傳統(tǒng)粗晶態(tài)的鈦合金相比,具有很多獨特理化性能如其高的活化能可有效促進鈦合金材料表面鈣磷沉積和體
內(nèi)骨整合����。因此,通過鈦合金表面多尺度結(jié)構(gòu)設(shè)計�,可以探索如何利用材料表面微納米尺度和拓撲結(jié)構(gòu)來控
制細胞的生長行為,為醫(yī)用鈦合金的設(shè)計和應(yīng)用奠定理論和技術(shù)基礎(chǔ)��,但圍繞醫(yī)用鈦合金表面多尺度結(jié)構(gòu)設(shè)
計�、加工制備的新方法新技術(shù)以及經(jīng)表面狀態(tài)優(yōu)化后與肌體界面之間的微觀作用機制仍需要深入研究。
生物材料的表面功能修飾在生物醫(yī)用材料的發(fā)展中起著至關(guān)重要的作用��,它是一個融合交叉了材料科學(xué)
和生物科學(xué)等多學(xué)科的復(fù)雜系統(tǒng)工程��,需要兼顧生物醫(yī)學(xué)工程各領(lǐng)域的需要�。表面修飾是為介導(dǎo)材料表面與
細胞的相互作用并實現(xiàn)理想的表面修飾,它包括表面拓撲結(jié)構(gòu)���、特異性識別����、親水-疏水平衡、蛋白質(zhì)吸附
等各個方面�����,更重要的是力圖趨近調(diào)
控細胞在材料表面生長和凋亡這一動態(tài)雙向平衡,給細胞創(chuàng)造良好的人工ECMs環(huán)境����,達到對細胞表型的理想
表達并促進組織的重建和發(fā)揮其功能。如何控制生物醫(yī)用材料的生物響應(yīng)��,賦予其特異性是醫(yī)用材料表面修
飾的研究基礎(chǔ)和出發(fā)點����。生物醫(yī)用材料表面修飾的一個重要方面是賦予表面以細胞表面整聯(lián)蛋白所能識別和
結(jié)合的位點。由此可知����,面對生
物醫(yī)用金屬材料的巨大挑戰(zhàn),應(yīng)從材料與細胞的相互作用入手��,了解記錄細胞與材料之間�、細胞之間的信息
傳輸�,通過分子設(shè)計和結(jié)構(gòu)模擬,合成或制備出材料表面有活性的生物醫(yī)用材料。只有深入理解生物材料與
宿主的相互作用�����,如以鎖匙學(xué)為基礎(chǔ)的生物特異分子識別��,才能使生物材料表面修飾更為有效��。
隨著材料科學(xué)與冶金學(xué)��、機械工程���、生物學(xué)���、臨床醫(yī)學(xué)、化學(xué)��、物理����、影像學(xué)等學(xué)科的交叉發(fā)展,鈦合
金等醫(yī)用金屬材料研究也應(yīng)從被動適應(yīng)生物環(huán)境向具備細胞/基因活化和組織誘導(dǎo)功能的半生命方向�、組織
學(xué)適應(yīng)、誘導(dǎo)及參與生物體物質(zhì)和能量交換的功能性或智能化的生物材料方向發(fā)展�����。具有智能化的人工輔助
心臟、腦刺激器等鈦制有源醫(yī)療器械正
在成為醫(yī)治心衰和帕金森等運動障礙患者的福音����。
因此從組織工程學(xué)原理、基因控制和仿生原理�����、基質(zhì)控制礦化等研究思路出發(fā)����,研究鈦合金材料表面微
納化和多尺度結(jié)構(gòu)設(shè)計、理化性能調(diào)控及其與機體組織之間表面/界面的相互作用與微觀機制���,立足提高醫(yī)
用鈦合金材料的生物及力學(xué)相容性��,將是今后醫(yī)用鈦合金材料發(fā)展的重要研究方向和奮斗目標(biāo)��。
參 考 文 獻
[1] Niinomi M. Recent metallic materials for biomedical applications [J]. Metall. Mater.
Trans., 2002, 33A: 477
[2] Bothe R T, Beaton L E, Davenport H A. Reaction of bone to multi-ple metallic implants
[J]. Surg. Gynecol. Obstet., 1940, 71: 598
[3] Leventhal G S. Titanium, a metal for surgery [J]. J. Bone Joint Surg. Am., 1951, 33A:
473
[4] Br?nemark P I, Breine U, Adell R, et al. Intra-osseous anchorage of dental prostheses:
I. Experimental studies [J]. Scand. J. Plast. Re-constr. Surg., 1969, 3: 81
[5] Br?nemark P, Hansson B, Adell R, et al. Osseointegrated implants in the treatment of
the edentulous jaw. Experience from a 10-year period [J]. Scand. J. Plast. Reconstr. Surg.
Suppl., 1977, 16: 1
[6] Geetha M, Singh A K, Asokamani R, et al. Ti based biomaterials,the ultimate choice for
orthopaedic implants—A review [J]. Prog.Mater. Sci., 2009, 54: 397
[7] Long M, Rack H J. Titanium alloys in total joint replacement—Amaterials science
perspective [J]. Biomaterials, 1998, 19: 1621
[8] Kuroda D, Niinomi M, Morinaga M, et al. Design and mechanical properties of new b type
titanium alloys for implant materials [J].Mater. Sci. Eng., 1998, A243: 244
[9] Niinomi M. Recent research and development in titanium alloys for biomedical
applications and healthcare goods [J]. Sci. Technol. Adv. Mater., 2003, 4: 445
[10] Rack H J, Qazi J I. Titanium alloys for biomedical applications [J].Mater. Sci. Eng.,
2006, C26: 1269
[11] Semlitsch M, Staub F, Weber H. Titanium-aluminium-niobium al-loy, development for
biocompatible, high strength surgical im-plants [J]. Biomed. Eng., 1985, 30: 334
[12] Eisenbarth E, Velten D, Müller M, et al. Biocompatibility of b-stabilizing elements
of titanium alloys [J]. Biomaterials, 2004, 25:5705
[13] Wang K. The use of titanium for medical applications in the USA [J]. Mater. Sci.
Eng., 1996, A213: 134
[14] Yu Z T, Zhang Y F, Yuan S B, et al. Microstructure and wear resis-tance of a novel
Ti4Zr1Sn3Mo25Nb (TLM) alloy [J]. Rare. Met.Mater. Eng., 2008, 37(suppl. 4): 542
(于振濤, 張亞鋒, 袁思波等. 近 β型鈦合金 Ti4Zr1Sn3Mo25Nb(TLM)熱處理與材料強化研究 [J]. 稀
有金屬材料與工程, 2008,37(增刊4): 542)
[15] Yu Z T, Zhang Y F, Liu H, et al. Effects of alloy elements, process-ing and heat
treatment on mechanical properties of a near b type biomedical titanium alloy TiZrMoNb and
microstructure analysis,Rare Met. Mater. Eng., 2010, 39: 1795
(于振濤, 張亞峰, 劉 輝等. 合金元素����、加工與熱處理對新型近β型鈦合金TiZrMoNb力學(xué)性能的影響及
微觀分析 [J]. 稀有金屬材料與工程, 2010, 39: 1795)
[16] Yu Z T, Zhang M H, Tian Y X, et al. Designation and developmentof biomedical Ti
alloys with finer biomechanical compatibility in long-term surgical implants [J]. Front.
Mater. Sci., 2014, 8: 219
[17] Song Y, Xu D S, Yang R, et al. Theoretical study of the effects of alloying elements
on the strength and modulus of b- type bio-titanium alloys [J]. Mater. Sci. Eng., 1999, A260:
269
[18] Van Noort R. Titanium: The implant material of today [J]. J. Ma-ter. Sci., 1987, 22:
3801
[19] Takahashi E, Sakurai T, Watanabe S, et al. Effect of heat treatment and Sn content on
superelasticity in biocompatible TiNbSn alloys [J]. Mater. Trans., 2002, 43: 2978
[20] Niinomi M. Mechanical properties of biomedical titanium alloys [J]. Mater. Sci. Eng.,
1998, A243: 231
[21] Obbard E G, Hao Y L, Talling R J, et al. The effect of oxygen on α" martensite and
super elasticity in Ti- 24Nb-4Zr-8Sn [J]. Acta Mater., 2011, 59: 112
[22] Banerjee R, Nag S, Fraser H L. A novel combinatorial approach to the development of
beta titanium alloys for orthopaedic implants [J]. Mater. Sci. Eng., 2005, C25: 282
[23] Hu Q M, Li S J, Hao Y L, et al. Phase stability and elastic modulus of Ti alloys
containing Nb, Zr, and/or Sn from first-principles cal-culations [J]. Appl. Phys. Lett., 2008,
93: 121902
[24] Zhao L C, Cui C X, Liu S J, et al. Design and research on proper-ties of new type
metastable b-titanium alloys for biomedical appli-cations based on the d-electron alloy design
method [J]. Rare Met.Mater. Eng., 2008, 37: 108
(趙立臣, 崔春翔, 劉雙進等. 基于d電子合金設(shè)計方法的生物醫(yī)用新型亞穩(wěn)β鈦合金的設(shè)計及性能研究
[J]. 稀有金屬材料與工程, 2008, 37: 108)
[25] Yu Z T, Yu S, Zhang M H, et al. Design, development and applica-tion of novel
biomedical Ti alloy materials applied in surgical im-plants [J]. Mater. China, 2010, 29(12):
35
(于振濤, 余 森, 張明華等. 外科植入物用新型醫(yī)用鈦合金材料設(shè)計, 開發(fā)與應(yīng)用現(xiàn)狀及進展 [J]. 中
國材料進展, 2010, 29(12):35)
[26] Saito T, Furuta T, Hwang J H, et al. Multifunctional alloys ob-tained via a
dislocation- free plastic deformation mechanism [J].Science, 2003, 300: 464
[27] Fu Y Y, Yu Z T, Zhou L, et al. Influence of microstructure on ten-sile strength and
fracture toughness of a Ti-13Nb-13Zr alloy [J].Rare Met. Mater. Eng., 2005, 34: 881
(付艷艷, 于振濤, 周 廉等. 顯微組織對 Ti-13Nb-13Zr 醫(yī)用鈦合金力學(xué)性能的影響 [J]. 稀有金屬材
料與工程, 2005, 34: 881)
[28] Eylon D, Vassel A, Combres Y, et al. Issues in the development of beta titanium
alloys [J]. JOM, 1994, 46(7): 14
[29] Liang S J, Hou F Q, Li Y H, et al. Microstructure and mechanical properties of Ti45Nb
wires used in aviation rivets [J]. Rare Met.Mater. Eng., 2015, 44: 2203
(梁書錦, 侯峰起, 李英浩等. 航空緊固件用Ti-45Nb合金絲材的組織和性能 [J]. 稀有金屬材料與工程
, 2015, 44: 2203)
[30] Niinomi M, Hattori T, Morikawa K, et al. Development of low ri-gidity b-type titanium
alloy for biomedical applications [J]. Mater.Trans., 2002, 43: 2970
[31] Liu H H, Niinomi M, Nakai M, et al. Deformation-induced change-able Young's
modulus with high strength in b-type Ti-Cr-O alloys for spinal fixture [J]. J. Mech. Behav.
Biomed. Mater., 2014, 30:205
[32] Li Q, Niinomi M, Hieda J, et al. Deformation-induced w phase in modified Ti-29Nb-
13Ta-4.6Zr alloy by Cr addition [J]. Acta Bio-mater., 2013, 9: 8027
[33] Yilmazer H, Niinomi M, Nakai M, et al. Mechanical properties of a medical b-type
titanium alloy with specific microstructural evo-lution through high- pressure torsion [J].
Mater. Sci. Eng., 2013,C33: 2499
[34] Niinomi M, Nakai M, Hieda J. Development of new metallic al-loys for biomedical
applications [J]. Acta Biomater., 2012, 8: 3888
[35] Zhao X F, Niinomi M, Nakai M, et al. Optimization of Cr content of metastable b-type
Ti-Cr alloys with changeable Young's modu-lus for spinal fixation applications [J]. Acta
Biomater., 2012, 8:2392
[36] Zhao X L, Niinomi M, Nakai M. Relationship between various de-formation-induced
products and mechanical properties in metasta-ble Ti- 30Zr- Mo alloys for biomedical
applications [J]. J. Mech.Behav. Biomed. Mater., 2011, 4: 2009
[37] Zhao X L, Niinomi M, Nakai M, et al. Microstructures and me-chanical properties of
metastable Ti- 30Zr- (Cr, Mo) alloys with changeable Young's modulus for spinal fixation
applications [J].Acta Biomater., 2011, 7: 3230
[38] Lütjering G, Williams J C. Titanium [M]. Berlin Heidelberg:Springer, 2007: 59
[39] Zhang Y M, Zhou L, Sun J, et al. Progress of vacuum arc remelt-ing technology of
titanium alloys [J]. Rare Met. Lett., 2008, 27(5):9
(張英明, 周 廉, 孫 軍等. 鈦合金真空自耗電弧熔煉技術(shù)發(fā)展[J]. 稀有金屬快報, 2008, 27(5): 9)
[40] Lei W G, Zhao Y Q, Han D, et al. Development of melting technol-ogy for titanium and
titanium alloys [J]. Mater. Rev., 2016, 30(5):101
(雷文光, 趙永慶, 韓 棟等. 鈦及鈦合金熔煉技術(shù)發(fā)展現(xiàn)狀 [J].材料導(dǎo)報, 2016, 30(5): 101)
[41] Wang C, Mao X N, Yu L L, et al. Development of melting technol-ogy of titanium alloys
[J]. Hot Work. Technol., 2009, 38(17): 42
(王 琛, 毛小南, 于蘭蘭等. 鈦合金熔煉技術(shù)的進展 [J]. 熱加工工藝, 2009, 38(17): 42)
[42] Fox S, Patel A, Tripp D, et al. Recent developments in melting and casting
technologies for titanium alloys [A]. Proceedings of the 13th World Conference on Titanium
[C]. The Minerals, Metals &Materials Society, 2016
[43] Zhang L J, Zhou Z B, Chang H, et al. Segregation behavior and prevention measures of
beta titanium alloy with high molybdenum content [J]. Chin. J. Nonferrous. Met., 2013, 23:
2206
(張利軍, 周中波, 常 輝等. 高鉬含量β型鈦合金的偏析行為及預(yù)防措施 [J]. 中國有色金屬學(xué)報,
2013, 23: 2206)
[44] Sakamoto K, Kusamichi T, Nakagawa T, et al. Simulation on mac-ro segregation in large
forging ingots and VAR ingots [J]. J. Jpn Foundry Eng. Soc., 1998, 70: 21
[45] Leder M O, Gorina A V, Kornilova M A, et al. Definition method of thermal-physics
properties of titanium alloys and boundary data parameters for vacuum arc remelting process
[J]. Tsvetn. Met.,2016, (4): 70
[46] Ballantyne A S. The development and application of an integrated VAR process model
[J]. BHM Berg, 2016, 161(suppl. 1): 12
[47] Zheng Y B, Chen Z Q, Chen F, et al. Control of copper segregation for large size TA13
Titanium alloy ingot [J]. Titanium Ind. Prog.,2011, 28(4): 32
(鄭亞波, 陳戰(zhàn)乾, 陳 峰等. 大規(guī)格 TA13 鈦合金鑄錠 Cu 偏析控制 [J]. 鈦工業(yè)進展, 2011, 28(4):
32)
[48] Zhao Y Q, Liu J L, Zhou L. Analysis on the segregation of typical b alloying elements
of Cu, Fe and Cr in Ti alloys [J]. Rare Met.Mater. Eng., 2005, 34: 531
(趙永慶, 劉軍林, 周 廉. 典型 β型鈦合金元素 Cu, Fe 和 Cr 的偏析規(guī)律 [J]. 稀有金屬材料與工
程, 2005, 34: 531)
[49] Mir H E, Jardy A, Bellot J P, et al. Thermal behaviour of the con-sumable electrode
in the vacuum arc remelting process [J]. J. Ma-ter. Process. Technol., 2010, 210: 564
[50] Sankar M, Prasad V V S, Baligidad R G, et al. Effect of vacuum arc remelting and
processing parameters on structure and proper-ties of high purity niobium [J]. Int. J.
Refract. Met. Hard Mater.,2015, 50: 120
[51] Kou H C, Zhang Y J, Li P F, et al. Numerical simulation of titani-um alloy ingot
solidification structure during VAR process based on three- dimensional CAFé method [J]. Rare
Met. Mater. Eng.,2014, 43: 1537
[52] Zhang Y J, Kou H C, Li P F, et al. Simulation on solidification structure and
shrinkage porosity (hole) in TC4 ingot during vacu-um arc remelting process [J]. Spec. Cast.
Nonferrous Alloys,2012, 32: 418
(張穎娟, 寇宏超, 李鵬飛等. 真空自耗電弧熔煉TC4鑄錠的凝固組織和縮松縮孔的模擬 [J]. 特種鑄造
及有色合金, 2012, 32:418)
[53] Kennedy R L, Jones R M F, Davis R M, et al. Superalloys made by conventional vacuum
melting and a novel spray forming pro-cess [J]. Vacuum, 1996, 47: 819
[54] Zhang W, Lee P D, McLean M. Numerical simulation of dendrite white spot formation
during vacuum arc remelting of INCO-NEL718 [J]. Metall. Mater. Trans., 2002, 33A: 443
[55] Xu X, Zhang W, Lee P D. Tree-ring formation during vacuum arc remelting of INCONEL
718: Part II. Mathematical modeling [J].Metall. Mater. Trans., 2002, 33A: 1805
[56] Gartling D K, Sackinger P A. Finite element simulation of vacuum arc remelting [J].
Int. J. Numer. Methods Fluids, 1997, 24: 1271
[57] Tomono H, Hitomi Y, Ura S, et al. Mechanism of formation of the V-shaped segregation
in the large section continuous cast bloom [J]. Trans. Iron Steel Inst. Japan, 1984, 24: 917
[58] Xu X, Ward R M, Jacobs M H, et al. Tree-ring formation during vacuum arc remelting of
INCONEL 718: Part I. Experimental in-vestigation [J]. Metall. Mater. Trans., 2002, 33A: 1795
[59] Yang Z J. Coupling of multi-fields in VAR process of titanium alloy and its effects
on the solidification behaviors [D]. Xi'an:Northwestern Polytechnical University, 2011
(楊治軍. 鈦合金 VAR 過程多場耦合及其對凝固行為的影響[D]. 西安: 西北工業(yè)大學(xué), 2011)
[60] Fedotov S G, Chelidze T V, Kovneristyy Y K, et al. Phase transfor-mations during
heating of metastable alloys of the Ti- Ta system [J]. Phys. Met. Metallogr., 1986, 62: 109
[61] Zhou Y L, Niinomi M, Akahori T. Effects of Ta content on Young's modulus and
tensile properties of binary Ti-Ta alloys for biomedi-cal applications [J]. Mater. Sci. Eng.,
2004, A371: 283
[62] Margevicius R W, Cotton J D. Stress-assisted transformation in Ti-60 wt pct Ta alloys
[J]. Metall. Mater. Trans., 1998, 29A: 139
[63] Wang L, Lu W, Qin J, et al. Texture and superelastic behavior of cold-rolled TiNbTaZr
alloy [J]. Mater. Sci. Eng., 2008, A491: 372
[64] Takahashi M, Kikuchi M, Takada Y, et al. Mechanical properties and microstructures of
dental cast Ti- Ag and Ti- Cu alloys [J].Dent. Mater. J., 2002, 21: 270
[65] Hamzah E, Hastuti K, Hashim J. Effect of ageing temperature on the microstructures
and mechanical properties of Ti- Nb shape memory alloys [J]. Adv. Mater. Res., 2014, 1024: 304
[66] Inamura T, Kim J I, Kim H Y, et al. Composition dependent crys-tallography of α"-
martensite in Ti-Nb-based b-titanium alloy [J].Philos. Mag., 2007, 87: 3325
[67] Valiev R, Materials science: Nanomaterial advantage [J]. Nature,2002, 419: 887
[68] Valiev R Z, Langdon T G. Achieving exceptional grain refinement through severe
plastic deformation: New approaches for improv-ing the processing technology [J]. Metall.
Mater. Trans., 2011,42A: 2942
[69] Valiev R Z, Langdon T G. Principles of equal- channel angular pressing as a
processing tool for grain refinement [J]. Prog. Mater Sci., 2006, 51: 881
[70] Zhu Y T, Liao X Z. Nanostructured metals: Rretaining ductility [J].Nat. Mater., 2004,
3: 351
[71] Zhu Y T, Lowe T C, Valiev R Z, et al. Ultrafine-grained titanium for medical implants
[P]. US Pat, 6399215 B1, 2002
[72] Yu Z, Ma X, Wang G, et al. Microstructure and mechanical proper- ties of biomedical
near-b Ti alloy TLM with nanostructure by ARB process [J], Ti 2011-Proceeding of the 12th
World Confer-ence on Titanium [C], Science Press, 2012: 2054
[73] Ma X Q, Yu Z T, Niu J L, et al. Microstructure and properties of ul-trafine grained
TLM alloy ARB sheet [J]. Rare Met. Mater. Eng.,2014, 43(suppl. 1): 152
(麻西群, 于振濤, 牛金龍等. 超細晶 TLM 鈦合金復(fù)合板材的組織與性能 [J]. 稀有金屬材料與工程,
2014, 43(增刊1): 152
[74] Kent D, Wang G, Yu Z T, et al. Strength enhancement of a biomed-ical titanium alloy
through a modified accumulative roll bonding technique [J]. J. Mech. Behav. Biomed. Mater.,
2011, 4: 405
[75] Buettner K M, Valentine A M. Bioinorganic chemistry of titanium [J]. Chem. Rev.,
2012, 112: 1863
[76] Bertollo N, Da Assuncao R, Hancock N J, et al. Influence of elec-tron beam melting
manufactured implants on ingrowth and shear strength in an ovine model [J]. J. Arthroplasty,
2012, 27: 1429
[77] Butscher A, Bohner M, Hofmann S, et al. Structural and material approaches to bone
tissue engineering in powder-based three-dimensional printing [J]. Acta Biomater., 2011, 7:
907
[78] Bartolo P, Kruth J P, Silva J, et al. Biomedical production of im-plants by additive
electro- chemical and physical processes [J].CIRP Ann.-Manuf. Technol., 2012, 61: 635
[79] Wehm?ller M, Warnke P H, Zilian C, et al. Implant design and production—A new
approach by selective laser melting [J]. Int.Congress Ser., 2005, 1281: 690
[80] Tian Y X, Yu Z T, Ong C Y A, et al. Microstructure, elastic defor-mation behavior and
mechanical properties of biomedical β-type titanium alloy thin- tube used for stents [J]. J.
Mech. Behav.Biomed. Mater., 2015, 45: 132
[81] Yu S, Yu Z T, Wang G, et al. Biocompatibility and osteoconduction of active porous
calcium-phosphate films on a novel Ti-3Zr-2Sn-3Mo- 25Nb biomedical alloy [J]. Colloids Surf.,
2011, 85B: 103
[82] Bansiddhi A, Sargeant T D, Stupp S I, et al. Porous NiTi for bone implants: A review
[J]. Acta Biomater., 2008, 4: 773
[83] Bose S, Vahabzadeh S, Bandyopadhyay A. Bone tissue engineer-ing using 3D printing
[J]. Mater. Today, 2013, 16: 496
[84] Li J P, Habibovic P, van den Doel M, et al. Bone ingrowth in po-rous titanium
implants produced by 3D fiber deposition [J]. Bio-materials, 2007, 28: 2810
[85] Parthasarathy J, Starly B, Raman S, et al. Mechanical evaluation of porous titanium
(Ti6Al4V) structures with electron beam melt-ing (EBM) [J]. J. Mech. Behav. Biomed. Mater.,
2010, 3: 249
[86] Pattanayak D K, Fukuda A, Matsushita T, et al. Bioactive Ti metal analogous to human
cancellous bone: Fabrication by selective laser melting and chemical treatments [J]. Acta
Biomater., 2011, 7: 1398
[87] Murr L E, Martinez E, Amato K N, et al. Fabrication of metal and alloy components by
additive manufacturing: Examples of 3D ma-terials science [J]. J. Mater. Res. Technol., 2012,
1: 42
[88] St-Pierre J P, Gauthier M, Lefebvre L P, et al. Three-dimensional growth of
differentiating MC3T3-E1 pre-osteoblasts on porous ti-tanium scaffolds [J]. Biomaterials,
2005, 26: 7319
[89] Jiang S W, Qi M. Development of porous metals used as biomateri-als [J]. Mater. Sci.
Eng., 2002, 20: 597
(姜淑文, 齊 民. 生物醫(yī)用多孔金屬材料的研究進展 [J]. 材料科學(xué)與工程, 2002, 20: 597)
[90] Levine B R, Sporer S, Poggie R A, et al. Experimental and clinical performance of
porous tantalum in orthopedic surgery [J]. Bioma-terials, 2006, 27: 4671
[91] Geng L X, Gan H Q, Wang Q, et al. Effect of domestic porous tan-talum on
biocompatibility and osteogenic gene expression in rat osteoblasts [J]. J. Third. Mil. Med.
Univ., 2014, 36: 1163
(耿麗鑫, 甘洪全, 王 茜等. 國產(chǎn)多孔鉭對成骨細胞生物相容性及其相關(guān)成骨基因表達的影響 [J]. 第
三軍醫(yī)大學(xué)學(xué)報, 2014,36: 1163)
[92] Wang C H, Yang C D, Liu M, et al. Martensitic microstructures and mechanical
properties of as- quenched metastable b- type Ti-Mo alloys [J]. J. Mater. Sci., 2016, 51: 6886
[93] Hao Y L, Yang R, Li S J, et al. Ageing response of Young's modu-lus and
mechanical properties of Ti-29Nb-13Ta-4.6Zr for biomedi-cal applications [J]. Acta Metall.
Sin., 2002, 38(suppl.): 126
(郝玉琳, 楊 銳, 李述軍等. 時效處理對Ti-29Nb-13Ta-4.6Zr醫(yī)用鈦合金 Young's 模量和力學(xué)性
能的影響 [J]. 金屬學(xué)報, 2002, 38(增刊): 126)
[94] Miura K, Yamada N, Hanada S, et al. The bone tissue compatibili-ty of a new Ti-Nb-Sn
alloy with a low Young's modulus [J]. Acta Biomater., 2011, 7: 2320
[95] Ohmori Y, Ogo T, Nakai K, et al. Effects of w-phase precipitation on b→a, a′′
transformations in a metastable b titanium alloy [J].Mater. Sci. Eng., 2001, A312: 182
[96] Mantani Y, Takemoto Y, Hida M, et al. Phase transformation of α"martensite structure
by aging in Ti-8 mass % Mo alloy [J]. Mater.Trans., 2004, 45: 1629
[97] Hanada S, Izumi O. Transmission electron microscopic observa-tions of mechanical
twinning in metastable beta titanium alloys [J]. Metall. Trans., 1986, 17A: 1409
[98] Zhao X F, Niinomi M, Nakai M, et al. Beta type Ti-Mo alloys with changeable
Young's modulus for spinal fixation applications [J].Acta Biomater., 2012, 8: 1990
[99] Nakai M, Niinomi M, Zhao X L, et al. Young's modulus change-able titanium alloys
for orthopaedic applications [J]. Mater. Sci.Forum, 2012, 706-709: 557
[100] Nakai M, Niinomi M, Zhao X F, et al. Self-adjustment of Young's modulus in
biomedical titanium alloys during orthopaedic opera-tion [J]. Mater. Lett., 2011, 65: 688
[101] Niinomi M, Liu Y, Nakai M, et al. Biomedical titanium alloys with Young's moduli
close to that of cortical bone [J]. Regen.Biomater., 2016, 3:173
[102] Ma X Q, Han Y, Yu Z T, et al. Phase transformation and mechani-cal properties of TLM
titanium alloy for orthopaedic implant ap-plication [J]. Rare Met. Mater. Eng., 2012, 41: 1535
(麻西群, 憨 勇, 于振濤等. 骨科植入用 TLM 鈦合金的相轉(zhuǎn)變與力學(xué)性能 [J]. 稀有金屬材料與工程,
2012, 41: 1535)
[103] Ma X Q, Yu Z T, Niu J L, et al. Microstructure and mechanical properties of Ti-3Zr-
Mo-15Nb medical titanium alloys [J]. RareMet. Mater. Eng., 2010, 39: 1956
(麻西群, 于振濤, 牛金龍等. Ti-3Zr-Mo-15Nb 醫(yī)用鈦合金的顯微組織及力學(xué)性能 [J]. 稀有金屬材料
與工程, 2010, 39: 1956)
[104] Beder O E, Stevenson J K, Jones T W. A further investigation of the surgical
application of titanium metal in dogs [J]. Surgery,1957, 41: 1012
[105] Pye A D, Lockhart D E A, Dawson M P, et al. A review of dental implants and
infection [J]. J. Hosp. Infect., 2009, 72: 104
[106] Mow V C, Huiskes R, translated by Tang T T, Pei G X, Li X, et al. Basic Orthopaedic
Biomechanics and Mechano-Biology [M].3rd Ed., Jinan: Shandong Science and Technology Press,
2009: 13
(Mow V C, Huiskes R 著, 湯亭亭, 裴國獻, 李 旭等譯. 骨科生物力學(xué)暨力學(xué)生物學(xué) [M]. 第 3 版.
濟南: 山東科學(xué)技術(shù)出版社, 2009: 13)
[107] Yu Z T, Zhang M H, Yu S, et al. Analysis of R&D, production and application of
biomedical Ti alloys materials applied in medi-cal devices of China [J]. China Med. Device
Inform., 2012,18(7): 1
(于振濤, 張明華, 余 森等. 中國醫(yī)療器械用鈦合金材料研發(fā)、生產(chǎn)與應(yīng)用現(xiàn)狀分析 [J]. 中國醫(yī)療器
械信息, 2012, 18(7): 1)
[108] Yu Z T, Yu S, Zhang M H, et al. Design, development and appli-cation of novel
biomedical Ti alloy materials applied in surgical implants [J]. Mater. China, 2010, 29(12): 35
(于振濤, 余 森, 張明華等. 外科植入物用新型醫(yī)用鈦合金材料設(shè)計、開發(fā)與應(yīng)用現(xiàn)狀及進展 [J]. 中
國材料進展, 2010,29(12): 35)
[109] Hao Y L, Yang R. Biomedical titanium alloy with ultralow elastic modulus and high
strength [J]. Mater. Sci. Forum, 2010, 654:2130
[110] Yu Z T, Ma X Q, Yu S, et al. Micro-nano technology and latest progress of biomedical
titanium alloy [J]. Chin. J. Nonferrous Met., 2010, 20(suppl. 1): 1008
(于振濤, 麻西群, 余 森等. 生物醫(yī)用鈦合金的微納化加工技術(shù)及最新進展 [J]. 中國有色金屬學(xué)報,
2010, 20(增刊1): 1008)
[111] Yu Z T, Han J Y, Ma X Q, et al. Biological and mechanical com-patibility of
biomedical titanium alloy materials [J]. Chin. J. Tis-sue Eng. Res., 2013, 17: 4707
(于振濤, 韓建業(yè), 麻西群等. 生物醫(yī)用鈦合金材料的生物及力學(xué)相容性 [J]. 中國組織工程研究,
2013, 17: 4707)
[112] Xi T F. Evaluation of biology based on medical devices [J]. Chi-na Med. Device
Inform., 1999, 5(3): 4
(奚廷斐. 醫(yī)療器械生物學(xué)評價 [J]. 中國醫(yī)療器械信息, 1999,5(3): 4)
[113] Okazaki Y, Ito Y, Kyo K, et al. Corrosion resistance and corro-sion fatigue strength
of new titanium alloys for medical implants without V and Al [J]. Mater. Sci. Eng., 1996,
A213: 138
[114] Okazaki Y, Gotoh E. Comparison of metal release from various metallic biomaterials
in vitro [J]. Biomaterials, 2005, 26: 11
[115] Sumner D R, Galante J O. Determinants of stress shielding: De-sign versus materials
versus interface [J]. Clin. Orthop. Relat.Res., 1992, 274: 202
[116] Li Y H, Yang C, Zhao H D, et al. New developments of Ti-based alloys for biomedical
applications [J]. Materials, 2014, 7: 1709
[117] Matsuno H, Yokoyama A, Watari F, et al. Biocompatibility and osteogenesis of
refractory metal implants, titanium, hafnium, nio-bium, tantalum and rhenium [J].
Biomaterials, 2001, 22: 1253
[118] Cremasco A, Messias A D, Esposito A R, et al. Effects of alloying elements on the
cytotoxic response of titanium alloys [J]. Mater.Sci. Eng., 2011, C31: 833
[119] Elias C N, Lima J H C, Valiev R, et al. Biomedical applications of titanium and its
alloys [J]. JOM, 2008, 60: 46
[120] Kirmanidou Y, Sidira M, Drosou M E, et al. New Ti-alloys and surface modifications
to improve the mechanical properties and the biological response to orthopedic and dental
implants: A re-view [J]. BioMed Res. Int., 2016, 2016: 2908570
[121] Dohan Ehrenfest D M, Coelho P G, Kang B S, et al. Classifica-tion of osseointegrated
implant surfaces: Materials, chemistry and topography [J]. Trends Biotechnol., 2010, 28: 198
[122] Richert L, Vetrone F, Yi J H, et al. Surface nanopatterning to con-trol cell growth
[J]. Adv. Mater., 2008, 20: 1488
[123] Zhang C B, Chen F L, Zhang R, et al. Experimental research on the osteoblasts
function on Ti- 75 alloy [J]. J. Pract. Stomatol.,2000, 16: 24
(張春寶, 陳富林, 張 蓉等. Ti-75合金對人成骨細胞的生長�����、增殖和功能分化的影響 [J]. 實用口腔
醫(yī)學(xué)雜志, 2000, 16: 24)
[124] Hernandez-Rodriguez M A L, Contreras-Hernandez G R, Juarez-Hernandez A, et al.
Failure analysis in a dental implant [J]. Eng.Fail. Anal., 2015, 57: 236
[125] Zhao F, Han Y F, Hu J F. Three-dimensional finite element meth-od analysis of
relation of implant elastic modulus and initial stress and bone- implant surface stress
distribution [J]. Chin. J.Oral Implantol., 2006, 11(2): 55(趙 峰, 韓彥峰, 胡江峰. 彈性模量和初
始應(yīng)力對種植體骨界面應(yīng)力分布影響的三維有限元分析 [J]. 中國口腔種植學(xué)雜志,2006, 11(2): 55)
[126] Su Y C. Contemporary Oral Implantology [M]. Beijing: People's Medical Publishing
House, 2004: 91
(宿玉成. 現(xiàn)代口腔種植學(xué) [M]. 北京: 人民衛(wèi)生出版社, 2004:91)
[127] Wang Q T, Zhang Y M, Hu N S, et al. Microstructure analysis of fractured Ti alloy
implant [J]. Rare Met. Mater. Eng., 2004, 33:442
(王勤濤, 張玉梅, 胡奈賽等. 鈦合金種植體臨床斷裂的原因分析 [J]. 稀有金屬材料與工程, 2004,
33: 442)
[128] Shemtov-Yona K, Rittel D. Identification of failure mechanisms in retrieved
fractured dental implants [J]. Eng. Fail. Anal., 2014,38: 58
[129] Kuramoto S, Furuta T, Hwang J H, et al. Plastic deformation in a multifunctional
Ti-Nb-Ta-Zr-O alloy [J]. Metall. Mater. Trans.,2006, 37A: 657
[130] Yu Z T, Zhou L, Luo L J, et al. Investigation on mechanical com-patibility matching
for biomedical titanium alloys [J]. Key Eng.Mater., 2005, 288-289: 595
[131] Abdel-Hady G M, Niinomi M. Biocompatibility of Ti-alloys for long- term implantation
[J]. J. Mech. Behav. Biomed. Mater.,2013, 20: 407
[132] Shibata Y, Tanimoto Y, Maruyama N, et al. A review of improved fixation methods for
dental implants. Part II: Biomechanical in-tegrity at bone-implant interface [J]. J.
Prosthodont. Res., 2015,59: 84
[133] DeTolla D H, Andreana S, Patra A, et al. Role of the finite ele-ment model in dental
implants [J]. J. Oral Implantol., 2000, 26:77
[134] Yu Z, Lian Z. Influence of martensitic transformation on mechani-cal compatibility
of biomedical b type titanium alloy TLM [J].Mater. Sci. Eng., 2006, A438: 391
[135] Bai X, Zhao Y, Zeng W, et al. Deformation mechanism and mi-crostructure evolution of
TLM titanium alloy during cold and hot compression [J]. Rare Met. Mater. Eng., 2015, 44: 1827)
[136] Suchanek K, Bartkowiak A, Gdowik A, et al. Crystalline hy-droxyapatite coatings
synthesized under hydrothermal conditions on modified titanium substrates [J]. Mater. Sci.
Eng., 2015, C51:57
[137] Liu J, Wang X D, Jin Q M, et al. The stimulation of adipose-derived stem cell
differentiation and mineralization by ordered rod-like fluorapatite coatings [J].
Biomaterials, 2012, 33: 5036
[138] Xue B J, Guo L T, Chen X Y, et al. Electrophoretic deposition and laser cladding of
bioglass coating on Ti [J]. J. Alloys Compd., 2017, 710: 663
[139] Wen F, Huang N, Sun H, et al. The study of composition, struc-ture, mechanical
properties and platelet adhesion of Ti- O/TiN gradient films prepared by metal plasma
immersion ion implanta-tion and deposition [J]. Nucl. Instrum. Methods Phys. Res. Sect.,2004,
222B: 81
[140] Hwang I J, Choe H C, Brantley W A. Electrochemical characteris-tics of Ti-6Al-4V
after plasma electrolytic oxidation in solutions containing Ca, P, and Zn ions [J]. Surf.
Coat. Technol., 2017,320: 458
[141] Zhou M, Xiong P, Jia Z J, et al. Improved the in vitro cell compat-ibility and
apatite formation of porous Ti6Al4V alloy with mag-nesium by plasma immersion ion implantation
[J]. Mater. Lett.,2017, 202: 9
[142] Schmehl J M, Harder C, Wendel H P, et al. Silicon carbide coat-ing of nitinol stents
to increase antithrombogenic properties and reduce nickel release [J]. Cardiovasc. Revasc.
Med., 2008, 9: 255
[143] Huang C L, Zhao C L, Han P, et al. Histological and biomechani-cal evaluation in the
interface between nano-surface titanium al-loy implants and bone [J]. Chin. J. Tissue Eng.
Res., 2011, 15:3867
(黃成龍, 趙常利, 韓 培等. 納米化表面鈦合金內(nèi)植物的界面組織學(xué)和生物力學(xué)評價 [J]. 中國組織工
程研究與臨床康復(fù),2011, 15: 3867)
[144] Gu X F, Jiang Y, Han P, et al. Effect of the nano-surface of titani-um alloy on the
adhesion of osteoblasts [J]. Chin. J. Clin. Rehab.,2006, 10(25): 46
(顧新豐, 蔣 垚, 韓 培等. 鈦合金表面納米化對成骨細胞黏附的影響 [J]. 中國臨床康復(fù), 2006, 10
(25): 46)
[145] Hélary G, Noirclère F, Mayingi J, et al. A new approach to graft bioactive polymer
on titanium implants: Improvement of MG 63 cell differentiation onto this coating [J]. Acta
Biomater., 2009, 5:124
[146] Hoshikawa Y, Onoki T, Akao M, et al. Blood compatibility and tissue responsiveness
on simple and durable methylsiloxane coat-ing [J]. Mater. Sci. Eng., 2012, C32: 1627
[147] Pegg E C, Walker G S, Scotchford C A, et al. Mono-functional aminosilanes as primers
for peptide functionalization [J]. J.Biomed. Mater. Res., 2009, 90A: 947
[148] Zhang F, Zhang Z B, Zhu X L, et al. Silk-functionalized titanium surfaces for
enhancing osteoblast functions and reducing bacteri-al adhesion [J]. Biomaterials, 2008, 29:
4751
[149] Neoh K G, Hu X F, Zheng D, et al. Balancing osteoblast func-tions and bacterial
adhesion on functionalized titanium surfaces [J]. Biomaterials, 2012, 33: 2813
[150] Rychly J, Nebe B J. Cell-material interaction [J]. BioNanoMateri-als, 2013, 14: 153
[151] Huang R, Lu S M, Han Y. Role of grain size in the regulation of osteoblast response
to Ti-25Nb-3Mo-3Zr-2Sn alloy [J]. ColloidsSurf., 2013, 111B: 232
[152] Hanawa T. Biofunctionalization of titanium for dental implant [J]. Jpn. Dent. Sci.
Rev., 2010, 46: 93
[153] Foss B L, Ghimire N, Tang R G, et al. Bacteria and osteoblast ad-hesion to chitosan
immobilized titanium surface: A race for the surface [J]. Colloids Surf., 2015, 134B: 370
[154] Pessková V, Kubies D, Hulejová H, et al. The influence of im-plant surface
properties on cell adhesion and proliferation [J]. J.Mater. Sci. Mater. Med., 2007, 18: 465
[155] Mager M D, LaPointe V, Stevens M M. Exploring and exploiting chemistry at the cell
surface [J]. Nat. Chem., 2011, 3: 582
[156] Benoit D S W, Schwartz M P, Durney A R, et al. Small functional groups for
controlled differentiation of hydrogel-encapsulated hu-man mesenchymal stem cells [J]. Nat.
Mater., 2008, 7: 816
[157] Slater J, Boyce P, Jancaitis M, et al. Modulation of endothelial cell migration via
manipulation of adhesion site growth using nanopatterned surfaces [J]. ACS Appl. Mater.
Interfaces, 2015, 7:4390
[158] Paital S R, Dahotre N B. Calcium phosphate coatings for bio-implant applications:
Materials, performance factors, and meth-odologies [J]. Mater. Sci. Eng., 2009, R66: 1
[159] Sen Y U, Zhen-Tao Y U, Han J Y, et al. Haemocompatibility of Ti-3Zr-2Sn-3Mo-25Nb
biomedical alloy with surface hepariniza- tion using electrostatic self assembly technology
[J]. Trans. Non-ferrous Met. Soc. China, 2012, 22: 3046
[160] Koudelka P, Doktor T, Kytyr D, et al. Micromechanical proper-ties of biocompatible
materials for bone tissue engineering pro-duced by direct 3D printing [J]. Key Eng. Mater.,
2015, 662: 138
[161] Jakus A E, Rutz A L, Shah R N. Advancing the field of 3D bioma-terial printing [J].
Biomed. Mater., 2016, 11: 014102
[162] Hughes G, ?chsner A. Design, manufacture and testing of three-dimensional scaffolds
[J]. Adv. Struct. Mater., 2015, 71: 133
[163] Roach P, Eglin D, Rohde K, et al. Modern biomaterials: A review-bulk properties and
implications of surface modifications [J]. J.Mater. Sci. Mater. Med., 2007, 18: 1263
[164] Yu J, Lin X, Ma L, et al. Influence of laser deposition patterns on part distortion,
interior quality and mechanical properties by la-ser solid forming (LSF) [J]. Mater. Sci.
Eng., 2011, A528:1094
[165] Fukuda A, Takemoto M, Saito T, et al. Osteoinduction of porous Ti implants with a
channel structure fabricated by selective laser melting [J]. Acta Biomater., 2011, 7: 2327
[166] Heinl P, Müller L, K?rner C, et al. Cellular Ti-6Al-4V structures with
interconnected macro porosity for bone implants fabricated by selective electron beam melting
[J]. Acta Biomater., 2008, 4:1536
[167] Traini T, Mangano C, Sammons R L, et al. Direct laser metal sin-tering as a new
approach to fabrication of an isoelastic functional-ly graded material for manufacture of
porous titanium dental im-plants [J]. Dent. Mater., 2008, 24: 1525
[168] Murr L E, Quinones S A, Gaytan S M, et al. Microstructure and mechanical behavior of
Ti-6Al-4V produced by rapid-layer man-ufacturing, for biomedical applications [J]. J. Mech.
Behav.Biomed. Mater., 2009, 2: 20
[169] Parthasarathy J. A design for the additive manufacture of func-tionally graded
porous structures with tailored mechanical proper-ties for biomedical applications [J]. J.
Manuf. Process., 2011, 13:160
[170] Xiang L, Wang C, Zhang W, et al. Fabrication and characteriza-tion of porous Ti6Al4V
parts for biomedical applications using electron beam melting process [J]. Mater. Lett., 2009,
63: 403
[171] Horn T J, Harrysson O L A, Marcellin-Little D J, et al. Flexural properties of
Ti6Al4V rhombic dodecahedron open cellular struc-tures fabricated with electron beam melting
[J]. Addit. Manuf.,2014, 1-4: 2
[172] Rafi H K, Karthik N V, Gong H, et al. Microstructures and me-chanical properties of
Ti6Al4V parts fabricated by selective laser melting and electron beam melting[J]. J. Mater.
Eng. Perform.,2013, 22: 3872
[173] Li F, Wang Z, Zeng X. Microstructures and mechanical proper-ties of Ti6Al4V alloy
fabricated by multi-laser beam selective la-ser melting [J]. Mater. Lett., 2017, 199: 79
[174] Leuders S, Th?ne M, Riemer A, et al. On the mechanical behav-iour of titanium alloy
TiAl6V4 manufactured by selective laser melting: Fatigue resistance and crack growth
performance [J].Int. J. Fatigue, 2013, 48: 300
[175] Yang J, Wang J, Yuan T, et al. The enhanced effect of surface mi-crostructured
porous titanium on adhesion and osteoblastic differ-entiation of mesenchymal stem cells [J].
J. Mater. Sci. Mater.Med., 2013, 24: 2235
[176] Anselme K, Bigerelle M, Noel B, et al. Qualitative and quantita-tive study of human
osteoblast adhesion on materials with vari-ous surface roughnesses [J]. J. Biomed. Mater.
Res., 2000, 49A:155
[177] Tan X P, Tan Y J, Csl C, et al. Metallic powder-bed based 3D printing of cellular
scaffolds for orthopaedic implants: A state-of-the-art review on manufacturing, topological
design, mechanicalproperties and biocompatibility [J]. Mater. Sci. Eng., 2017, C76:1328
[178] Ru Z F, Li Y, Luo K, et al. Progress in low elastic modulus titani-um alloy [J].
Mater. Rev., 2011, 25(spec. issue): 250
(茹志芳, 李 巖, 羅 坤等. 低彈性模量鈦合金的研究進展 [J].材料導(dǎo)報, 2011, 25(特刊): 250)
[179] Bremus- Koebberling E A, Beckemper S, Koch B, et al. Nano structures via laser
interference patterning for guided cell growth of neuronal cells [J]. J. Laser. Appl., 2012,
24: 042013
[180] Munuera C, Matzelle T R, Kruse N, et al. Surface elastic proper-ties of Ti alloys
modified for medical implants: A force spectros-copy study [J]. Acta Biomater., 2007, 3: 113
[181] Mendon?a G, Mendon?a D B S, Sim?es L G P, et al. The effects of implant surface
nanoscale features on osteoblast-specific gene expression [J]. Biomaterials, 2009, 30: 4053
相關(guān)鏈接